高考化学知识点总结完整版思维导图

化学是一门历史悠久、充满活力的学科,它的成就是社会文明的重要标志。
树图思维导图提供 高考化学知识点总结完整版 在线思维导图免费制作,点击“编辑”按钮,可对 高考化学知识点总结完整版 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:11e6d93466db2f8a4581218d893dc287
思维导图大纲
高考化学知识点总结完整版思维导图模板大纲
化学是一门历史悠久、充满活力的学科,它的成就是社会文明的重要标志。那么高考化学知识点有哪些呢?为了方便大家学习借鉴,下面树图网精心准备了高考化学知识点总结完整版内容,欢迎使用学习!
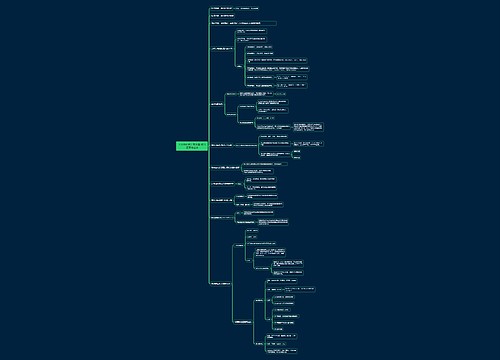
高考化学知识点总结
1、固体不一定都是晶体,如玻璃是非晶态物质,再如塑料、橡胶等。
2、最简式相同的有机物:①CH:C2H2和C6H6②CH2:烯烃和环烷烃③CH2O:甲醛、乙酸、甲酸甲酯④CnH2nO:饱和一元醛(或饱和一元酮)与二倍于其碳原子数和饱和一元羧酸或酯;举一例:乙醛(C2H4O)与丁酸及其异构体(C4H8O2)
3、一般原子的原子核是由质子和中子构成,但氕原子(1H)中无中子。
4、元素周期表中的每个周期不一定从金属元素开始,如第一周期是从氢元素开始。
5、ⅢB所含的元素种类最多。碳元素形成的化合物种类最多,且ⅣA族中元素组成的晶体常常属于原子晶体,如金刚石、晶体硅、二氧化硅、碳化硅等。
6、质量数相同的原子,不一定属于同种元素的原子,如18O与18F、40K与40Ca
7、ⅣA~ⅦA族中只有ⅦA族元素没有同素异形体,且其单质不能与氧气直接化合。
8、活泼金属与活泼非金属一般形成离子化合物,但AlCl3却是共价化合物(熔沸点很低,易升华,为双聚分子,所有原子都达到了最外层为8个电子的稳定结构)。
9、一般元素性质越活泼,其单质的性质也活泼,但N和P相反,因为N2形成叁键。
10、非金属元素之间一般形成共价化合物,但NH4Cl、NH4NO3等铵盐却是离子化合物。
11、离子化合物在一般条件下不存在单个分子,但在气态时却是以单个分子存在。如NaCl。
12、含有非极性键的化合物不一定都是共价化合物,如Na2O2、FeS2、CaC2等是离子化合物。
13、单质分子不一定是非极性分子,如O3是极性分子。
14、一般氢化物中氢为+1价,但在金属氢化物中氢为-1价,如NaH、CaH2等。
15、非金属单质一般不导电,但石墨可以导电,硅是半导体。
16、非金属氧化物一般为酸性氧化物,但CO、NO等不是酸性氧化物,而属于不成盐氧化物。
17、酸性氧化物不一定与水反应:如SiO2。
18、金属氧化物一般为碱性氧化物,但一些高价金属的氧化物反而是酸性氧化物,如:Mn2O7、CrO3等反而属于酸性氧物,2KOH+Mn2O7==2KMnO4+H2O。
19、非金属元素的最高正价和它的负价绝对值之和等于8,但氟无正价,氧在OF2中为+2价。
20、含有阳离子的晶体不一定都含有阴离子,如金属晶体中有金属阳离子而无阴离子。
21、离子晶体不一定只含有离子键,如NaOH、Na2O2、NH4Cl、CH3COONa等中还含有共价键。
22、稀有气体原子的电子层结构一定是稳定结构,其余原子的电子层结构一定不是稳定结构。
23、离子的电子层结构一定是稳定结构。
24、阳离子的半径一定小于对应原子的半径,阴离子的半径一定大于对应原子的半径。
25、一种原子形成的高价阳离子的半径一定小于它的低价阳离子的半径。如Fe3+
26、同种原子间的共价键一定是非极性键,不同原子间的共价键一定是极性键。
27、分子内一定不含有离子键。题目中有"分子"一词,该物质必为分子晶体。
28、单质分子中一定不含有极性键。
29、共价化合物中一定不含有离子键。
30、含有离子键的化合物一定是离子化合物,形成的晶体一定是离子晶体。
31、含有分子的晶体一定是分子晶体,其余晶体中一定无分子。
32、单质晶体一定不会是离子晶体。
33、化合物形成的晶体一定不是金属晶体。
34、分子间力一定含在分子晶体内,其余晶体一定不存在分子间力(除石墨外)。
35、对于双原子分子,键有极性,分子一定有极性(极性分子);键无极性,分子一定无极性(非极性分子)。
36、氢键也属于分子间的一种相互作用,它只影响分子晶体的熔沸点,对分子稳定性无影响。
37、微粒不一定都指原子,它还可能是分子,阴、阳离子、基团(如羟基、硝基等)。例如,具有10e-的微粒:Ne;O2-、F-、Na+、Mg2+、Al3+;OH-H3O+、CH4、NH3、H2O、HF。
38、失电子难的原子获得电子的能力不一定都强,如碳,稀有气体等。
39、原子的最外电子层有2个电子的元素不一定是ⅡA族元素,如He、副族元素等。
40、原子的最外电子层有1个电子的元素不一定是ⅠA族元素,如Cr、ⅠB族元素等。
41、ⅠA族元素不一定是碱金属元素,还有氢元素。
42、由长、短周期元素组成的族不一定是主族,还有0族。
43、分子内不一定都有化学键,如稀有气体为单原子分子,无化学键。
44、共价化合物中可能含非极性键,如过氧化氢、乙炔等。
45、含有非极性键的化合物不一定是共价化合物,如过氧化钠、二硫化亚铁、乙酸钠、CaC2等是离子化合物。
46、对于多原子分子,键有极性,分子不一定有极性,如二氧化碳、甲烷等是非极性分子。
47、含有阳离子的晶体不一定是离子晶体,如金属晶体。
48、离子化合物不一定都是盐,如Mg3N2、金属碳化物(CaC2)等是离子化合物,但不是盐。
49、盐不一定都是离子化合物,如氯化铝、溴化铝等是共价化合物。
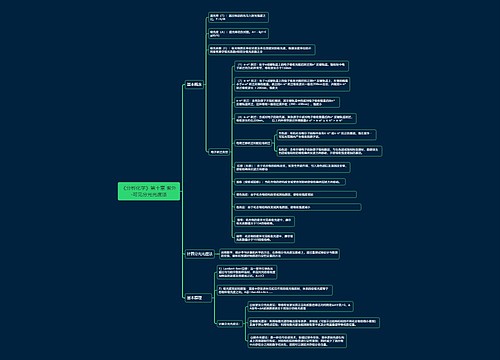
高考化学易错知识点
常错点1错误认为任何情况下,c(H+)和c(OH-)都可以通过KW=1×10-14进行换算。
辨析KW与温度有关,25 ℃时KW=1×10-14,但温度变化时KW变化,c(H+)和c(OH-)不能再通过KW=1×10-14进行换算。
常错点2错误认为溶液的酸碱性不同时,水电离出的c(OH-)和c(H+)也不相等。
辨析由水的电离方程式H2O===OH-+H+可知,任何水溶液中,水电离出的c(OH-)和c(H+)总是相等的,与溶液的酸碱性无关。
常错点3酸、碱、盐溶液中,c(OH-)或c(H+)的来源混淆。
辨析(1)酸溶液中,c(OH-)水电离=c(OH-)溶液;碱溶液中,c(H+)水电离=c(H+)溶液。
(2)盐溶液中,若为强酸弱碱盐,c(H+)水电离=c(H+)溶液;若为强碱弱酸盐,c(OH-)水电离=c(OH-)溶液。
常错点4错误认为只要Ksp越大,其溶解度就会越大。
辨析 Ksp和溶解度都能用来描述难溶电解质的溶解能力。但是只有同种类型的难溶电解质才能直接用Ksp的大小来判断其溶解度的大小;若是不同的类型,需要计算其具体的溶解度才能比较。
常错点5错误地认为原电池的两个电极中,相对较活泼的金属一定作负极。
辨析判断原电池的电极要根据电极材料和电解质溶液的具体反应分析,发生氧化反应的是负极,发生还原反应的是正极。
如在Mg—Al—稀H2SO4组成的原电池中,Mg为负极,而在Mg—Al—NaOH溶液组成的原电池中,Al作负极,因为Al可与NaOH溶液反应,Mg不与NaOH溶液反应。
常错点6在电解食盐水的装置中,错误地认为阳极区显碱性。
辨析电解食盐水时,阴极H+放电生成H2,使水的电离平衡正向移动,OH-浓度增大,阴极区显碱性。
常错点7错误地认为钠在过量氧气中燃烧生成Na2O2,在适量或少量氧气中燃烧生成Na2O
辨析钠与氧气的反应产物与反应条件有关,将金属钠暴露在空气中生成Na2O,在空气或氧气中燃烧生成Na2O2
常错点8错误地认为钝化就是不发生化学变化,铝、铁与浓硫酸、浓硝酸不发生反应。
辨析钝化是在冷的浓硫酸、浓硝酸中铝、铁等金属的表面形成一层致密的氧化膜而阻止了反应的进一步进行,如果加热氧化膜会被破坏,反应就会剧烈进行。所以钝化是因发生化学变化所致;铝、铁等金属只在冷的浓硫酸、浓硝酸中发生钝化,加热时会剧烈反应。
常错点9错误地认为,金属的还原性与金属元素在化合物中的化合价有关。
辨析在化学反应中,金属的还原性强弱与金属失去电子的难易程度有关,与失去电子的数目无关,即与化合价无关。
常错点10错误地认为可用酸性高锰酸钾溶液去除甲烷中的乙烯。
辨析乙烯被酸性高锰酸钾氧化后产生二氧化碳,故不能达到除杂目的,必须再用碱石灰处理。
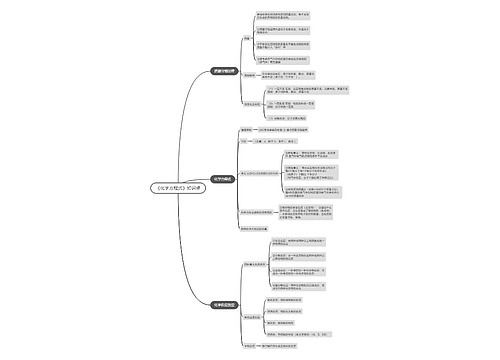
高考化学方程式配平方法
1.定一法
找到化学方程式中关键的化学式,定其化学式前计量数为1,然后根据关键化学式去配平其他化学式前的化学计量数。若出现计量数为分数,再将各计量数同乘以同一整数,化分数为整数,这种先定关键化学式计量数为1的配平方法,称为归一法。
2.最小公倍数法
这种方法适合常见的难度不大的化学方程式。例如,kclo3→kcl+o2↑在这个反应式中右边氧原子个数为2,左边是3,则最小公倍数为6,因此kclo3前系数应配2,o2前配3,式子变为:2kclo3→kcl+3o2↑,由于左边钾原子和氯原子数变为2个,则kcl前应配系数2,短线改为等号,标明条件即:2kclo3==2kcl+3o2↑
3.奇数变偶数法
选择反应前后化学式中原子个数为一奇一偶的元素作配平起点,将奇数变成偶数,然后再配平其他元素原子的方法称为奇数变偶数法。
4.零价法配平
对于fe3c,fe3p等化合物来说,某些元素化合价难以确定,此时可将fe3c,fe3p中各元素视为零价。零价法思想还是把fe3c,fe3p等物质视为一整价。
5.电子得失总数守恒法
这种方法是最普通的一方法,其基本配平步骤课本上已有介绍。这里介绍该配平时的一些技巧。对某些较复杂的氧化还原反应,如一种物质中有多个元素的化合价发生变化,可以把这种物质当作一个整体来考虑。
高考化学知识点总结完整版相关文章:
★ 2021年理综化学高考常考知识点整理最新
★ 2021高考化学复习的精华知识点总结2021
★ 2022化学高考常考备考知识点精选
★ 高考备考化学重点知识点整理2021
★ 高中化学高考必备知识要点总结2021
★ 2021人教版高三考生必读化学知识点归纳
★ 高考化学一轮复习知识点精华汇总2021
★ 高三化学知识点分享整理2021
★ 高三化学选修三章节知识点总结2021
相关思维导图模板

树图思维导图提供 1113爆卡会总结会会议纪要 在线思维导图免费制作,点击“编辑”按钮,可对 1113爆卡会总结会会议纪要 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:aaf6c152a765d5821e8e1787f2b3226e

树图思维导图提供 第1章 化工设计基本知识 在线思维导图免费制作,点击“编辑”按钮,可对 第1章 化工设计基本知识 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:70ec0519ed26419068a32a511862aadd








 上海工商
上海工商