《化学药品注册分类改革工作方案》政策解读(二)思维导图
一、国内上市销售的制剂增加已在国外批准的新适应症按什么申报? “国内上市销售的制剂增加已在国外批准的新适应症”相关申请事项,可按照现行《药品注册管理办法》附件4中国家局审批的补充申请事项第3项进行申报。 二、国内上市销售的制剂增加国内外均未批准的新适应症按什么申报? 按照新注册分类2.4进行申报。
树图思维导图提供 《化学药品注册分类改革工作方案》政策解读(二) 在线思维导图免费制作,点击“编辑”按钮,可对 《化学药品注册分类改革工作方案》政策解读(二) 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:f045b6c36ec639779cf94b2a0072562a
思维导图大纲
《化学药品注册分类改革工作方案》政策解读(二)思维导图模板大纲
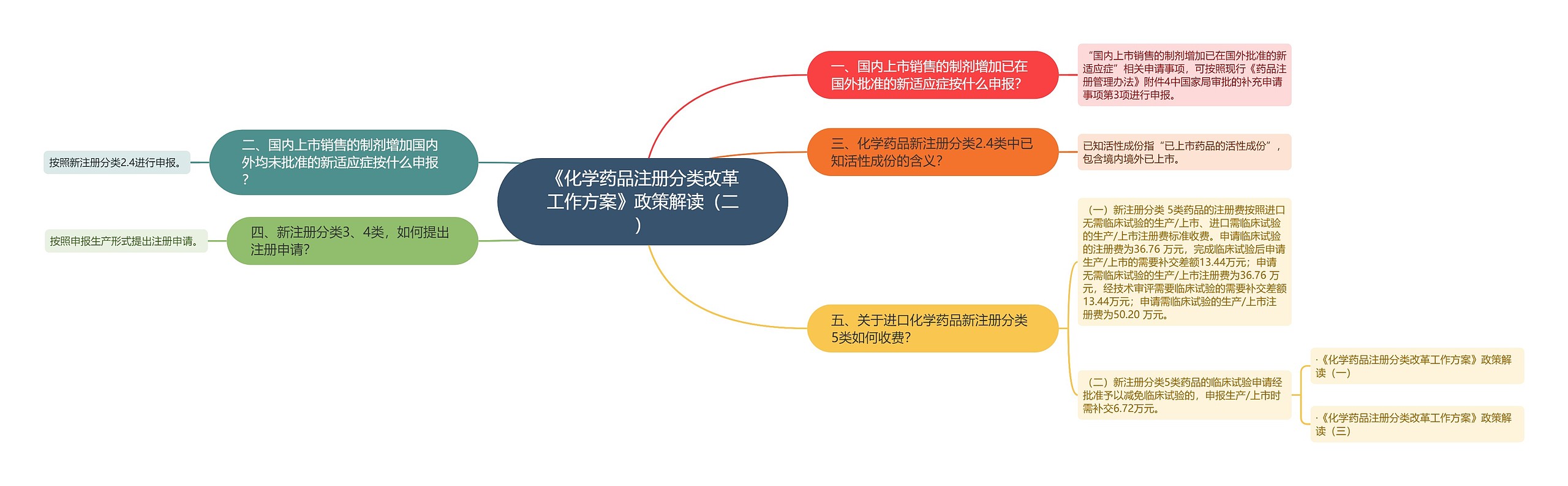
一、国内上市销售的制剂增加已在国外批准的新适应症按什么申报?
“国内上市销售的制剂增加已在国外批准的新适应症”相关申请事项,可按照现行《药品注册管理办法》附件4中国家局审批的补充申请事项第3项进行申报。
二、国内上市销售的制剂增加国内外均未批准的新适应症按什么申报?
按照新注册分类2.4进行申报。
三、化学药品新注册分类2.4类中已知活性成份的含义?
已知活性成份指“已上市药品的活性成份”,包含境内境外已上市。
四、新注册分类3、4类,如何提出注册申请?
按照申报生产形式提出注册申请。
五、关于进口化学药品新注册分类5类如何收费?
(一)新注册分类 5类药品的注册费按照进口无需临床试验的生产/上市、进口需临床试验的生产/上市注册费标准收费。申请临床试验的注册费为36.76 万元,完成临床试验后申请生产/上市的需要补交差额13.44万元;申请无需临床试验的生产/上市注册费为36.76 万元,经技术审评需要临床试验的需要补交差额13.44万元;申请需临床试验的生产/上市注册费为50.20 万元。
(二)新注册分类5类药品的临床试验申请经批准予以减免临床试验的,申报生产/上市时需补交6.72万元。
·《化学药品注册分类改革工作方案》政策解读(一)
·《化学药品注册分类改革工作方案》政策解读(三)
相关思维导图模板

树图思维导图提供 传感器与检测技术 在线思维导图免费制作,点击“编辑”按钮,可对 传感器与检测技术 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:72a40a7d84cb08fdf4f18e27e0756c07

树图思维导图提供 校园二手交易软件流程图 在线思维导图免费制作,点击“编辑”按钮,可对 校园二手交易软件流程图 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:dfee23d77dc924bd19610dac68bbfaf4
















 上海工商
上海工商