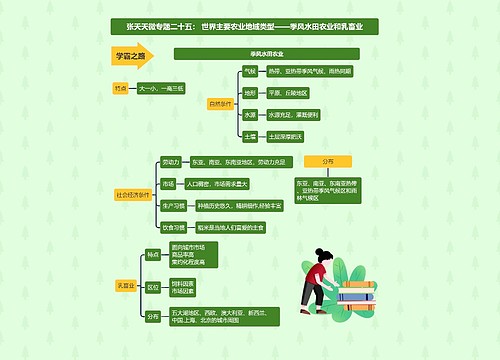
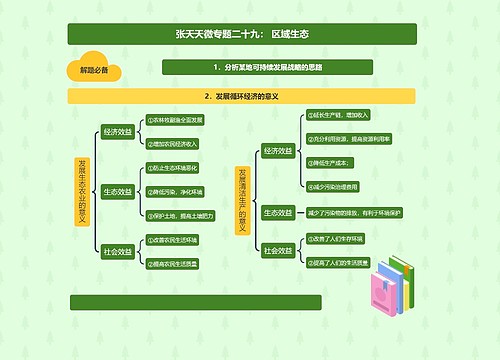
新药的申报与审批规定思维导图

新药的申报与审批规定: (1)新药的申报与审批分为临床研究和生产上市两个阶段。 (2)省级药品监督管理部门负责初审,国家药品监督管理局复审。 (3)进行优先审评制度。属于下列情况的优先审评。 ①新的中药材及其制剂,中药或者天然药物中提取的有效成分及其制剂。
树图思维导图提供 新药的申报与审批规定 在线思维导图免费制作,点击“编辑”按钮,可对 新药的申报与审批规定 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:591c32a4b9c8dd774342cd77af7105c3
思维导图大纲
新药的申报与审批规定思维导图模板大纲
新药的申报与审批规定:
(1)新药的申报与审批分为临床研究和生产上市两个阶段。
(2)省级药品监督管理部门负责初审,国家药品监督管理局复审。
(3)进行优先审评制度。属于下列情况的优先审评。
①新的中药材及其制剂,中药或者天然药物中提取的有效成分及其制剂。
②未在国内外获准上市的化学原料药及其制剂、生物制品。
③抗艾滋病毒及用于诊断、预防艾滋病的新药,治疗恶性肿瘤、罕见病的新药。
④治疗尚无有效治疗手段的疾病的新药。
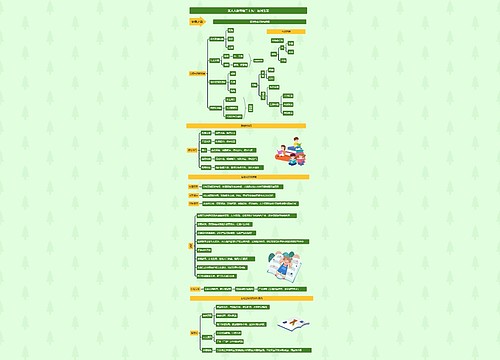
(4)增加新药监测期的管理。实施条例第70条规定SDA根据保护公众健康的要求,医|学教育网搜集整理可以对药品生产企业生产的新药设立不超过5年的检测期;在检测期内,不得批准其他企业生产和进口。
(5)非处方药的申报与审批。可申请非处方药的三种情形为:
①已有国家药品标准的非处方药的生产或进口;
②经国家药监局确定的非处方药改变剂型,医|学教育网搜集整理但不改变适应症、给药剂量以及给药途径的药品;
③使用国家药监局确定的非处方药活性成分组成新的复方剂型。
(6)药品补充申请的申报与审批。规定凡是变更药品批准证明文件及其所附药品标准、药品说明书、标签内载明事项的,以及改变生产工艺影响药品质量的,申请人应当提出补充申请。
(7)药品的再注册。规定药品批准证明文件有效期满后继续生产、进口的药品需进行药品的再注册。
(8)新药的批准文号 格式为:
试生产批准文号 国药试字X(或Z)××××××××
正式生产批准文号 国药准字X(或Z)××××××××
X:代表化学药品; Z:代表中药; 字母后的前4位数字为公元年号,后4位为年内顺序编号。
相关思维导图模板

树图思维导图提供 二手书销售平台新航标 在线思维导图免费制作,点击“编辑”按钮,可对 二手书销售平台新航标 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:a92403b70afada50cf4fa4f56e0981c9

树图思维导图提供 9.战斗的基督教 在线思维导图免费制作,点击“编辑”按钮,可对 9.战斗的基督教 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:33d168acd0cd9f767f809c7a5df86e3a








 上海工商
上海工商