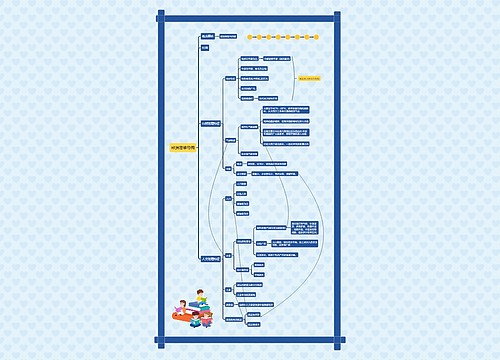
药品补充申请的申报|审批思维导图
药品补充申请的申报|审批: 第一百一十条 变更研制新药、生产药品和进口药品已获批准证明文件及其附件中载明事项的,应当提出补充申请。 申请人应当参照相关技术指导原则,评估其变更对药品安全性、有效性和质量可控性的影响,并进行相应的技术研究工作。
树图思维导图提供 药品补充申请的申报|审批 在线思维导图免费制作,点击“编辑”按钮,可对 药品补充申请的申报|审批 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:c5916043ffb2f1a0baefacc65663e994
思维导图大纲
药品补充申请的申报|审批思维导图模板大纲
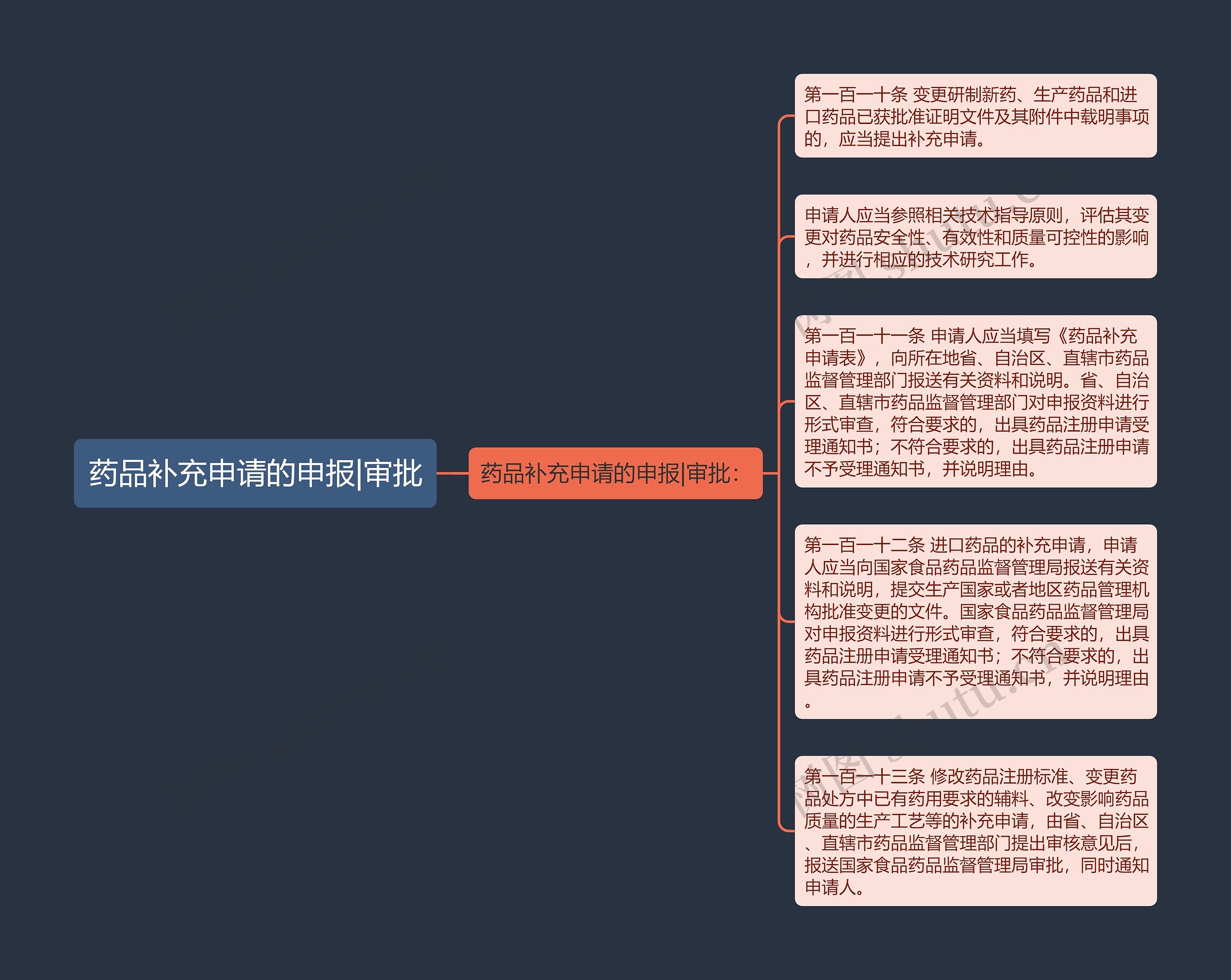
药品补充申请的申报|审批:
第一百一十条 变更研制新药、生产药品和进口药品已获批准证明文件及其附件中载明事项的,应当提出补充申请。
申请人应当参照相关技术指导原则,评估其变更对药品安全性、有效性和质量可控性的影响,并进行相应的技术研究工作。
第一百一十一条 申请人应当填写《药品补充申请表》,向所在地省、自治区、直辖市药品监督管理部门报送有关资料和说明。省、自治区、直辖市药品监督管理部门对申报资料进行形式审查,符合要求的,出具药品注册申请受理通知书;不符合要求的,出具药品注册申请不予受理通知书,并说明理由。
第一百一十二条 进口药品的补充申请,申请人应当向国家食品药品监督管理局报送有关资料和说明,提交生产国家或者地区药品管理机构批准变更的文件。国家食品药品监督管理局对申报资料进行形式审查,符合要求的,出具药品注册申请受理通知书;不符合要求的,出具药品注册申请不予受理通知书,并说明理由。
第一百一十三条 修改药品注册标准、变更药品处方中已有药用要求的辅料、改变影响药品质量的生产工艺等的补充申请,由省、自治区、直辖市药品监督管理部门提出审核意见后,报送国家食品药品监督管理局审批,同时通知申请人。
相关思维导图模板
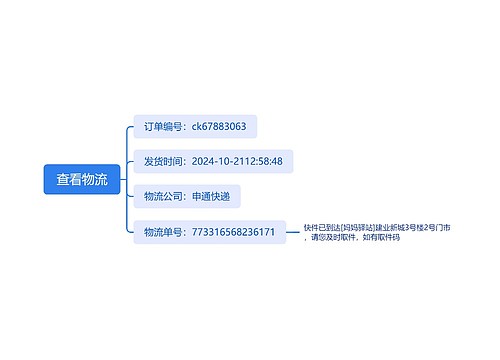

树图思维导图提供 查看物流 在线思维导图免费制作,点击“编辑”按钮,可对 查看物流 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:574e6104f4596d799f9ac726e005255f


树图思维导图提供 《党旗引领,逐梦前行》——新党员发展流程 在线思维导图免费制作,点击“编辑”按钮,可对 《党旗引领,逐梦前行》——新党员发展流程 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:fd1d42ed0c303989395cacc790f88223












 上海工商
上海工商