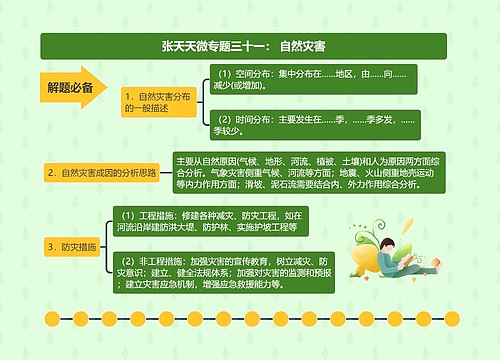
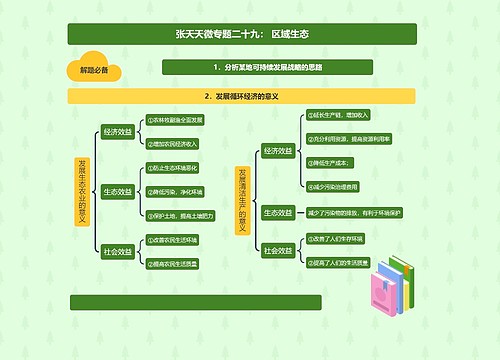
新药申请的申报与审批流程思维导图
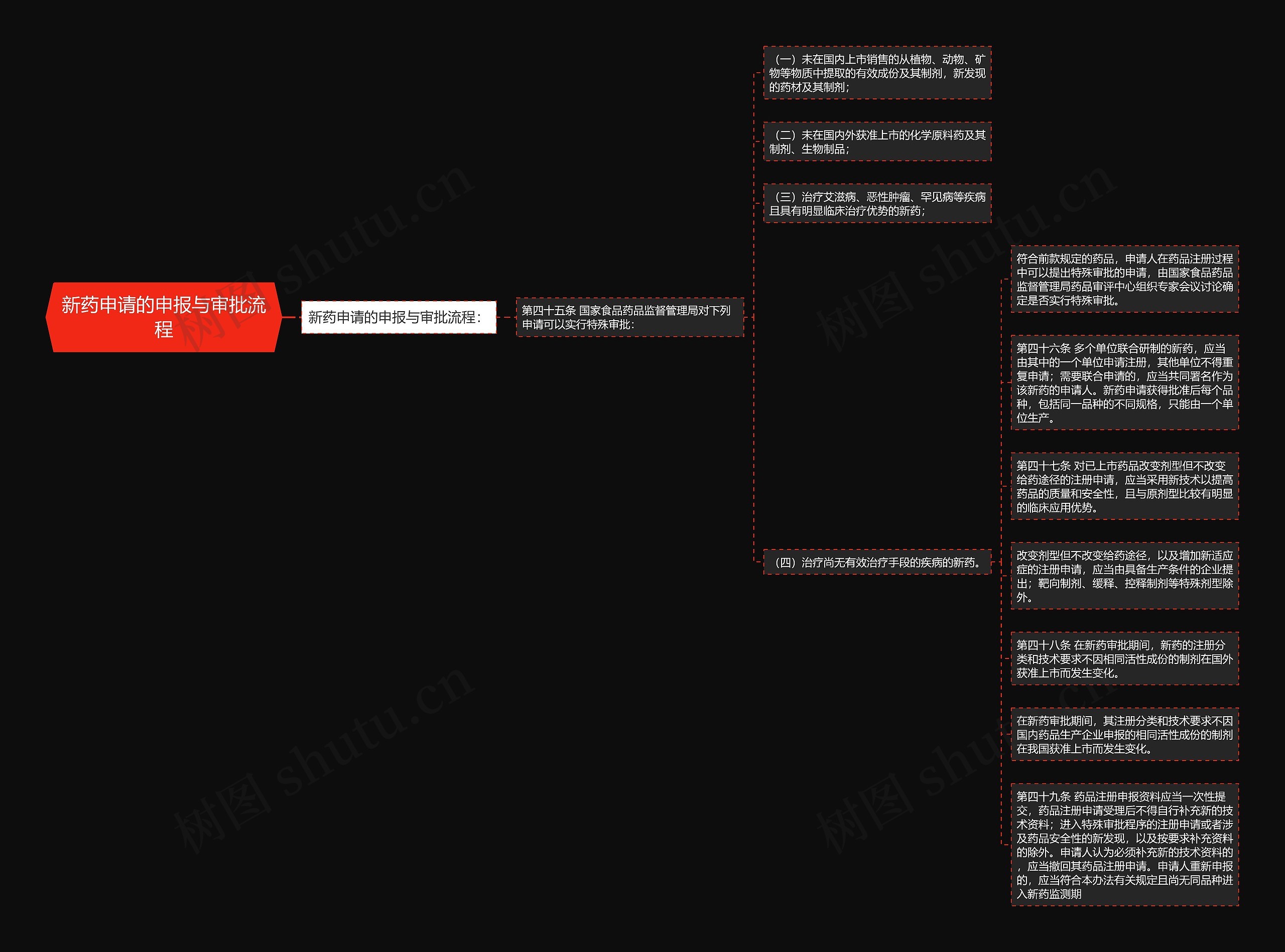
新药申请的申报与审批流程: 第四十五条 国家食品药品监督管理局对下列申请可以实行特殊审批: (一)未在国内上市销售的从植物、动物、矿物等物质中提取的有效成份及其制剂,新发现的药材及其制剂; (二)未在国内外获准上市的化学原料药及其制剂、生物制品; (三)治疗艾滋病、恶性肿瘤、罕见病等疾病且具有明显临床治
树图思维导图提供 新药申请的申报与审批流程 在线思维导图免费制作,点击“编辑”按钮,可对 新药申请的申报与审批流程 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:a2d6367ae500ed7616a5bbf8ee28f0ec
思维导图大纲
新药申请的申报与审批流程思维导图模板大纲
新药申请的申报与审批流程:
第四十五条 国家食品药品监督管理局对下列申请可以实行特殊审批:
(一)未在国内上市销售的从植物、动物、矿物等物质中提取的有效成份及其制剂,新发现的药材及其制剂;
(二)未在国内外获准上市的化学原料药及其制剂、生物制品;
(三)治疗艾滋病、恶性肿瘤、罕见病等疾病且具有明显临床治疗优势的新药;
(四)治疗尚无有效治疗手段的疾病的新药。
符合前款规定的药品,申请人在药品注册过程中可以提出特殊审批的申请,由国家食品药品监督管理局药品审评中心组织专家会议讨论确定是否实行特殊审批。
第四十六条 多个单位联合研制的新药,应当由其中的一个单位申请注册,其他单位不得重复申请;需要联合申请的,应当共同署名作为该新药的申请人。新药申请获得批准后每个品种,包括同一品种的不同规格,只能由一个单位生产。
第四十七条 对已上市药品改变剂型但不改变给药途径的注册申请,应当采用新技术以提高药品的质量和安全性,且与原剂型比较有明显的临床应用优势。
改变剂型但不改变给药途径,以及增加新适应症的注册申请,应当由具备生产条件的企业提出;靶向制剂、缓释、控释制剂等特殊剂型除外。
第四十八条 在新药审批期间,新药的注册分类和技术要求不因相同活性成份的制剂在国外获准上市而发生变化。
在新药审批期间,其注册分类和技术要求不因国内药品生产企业申报的相同活性成份的制剂在我国获准上市而发生变化。
第四十九条 药品注册申报资料应当一次性提交,药品注册申请受理后不得自行补充新的技术资料;进入特殊审批程序的注册申请或者涉及药品安全性的新发现,以及按要求补充资料的除外。申请人认为必须补充新的技术资料的,应当撤回其药品注册申请。申请人重新申报的,应当符合本办法有关规定且尚无同品种进入新药监测期
相关思维导图模板

树图思维导图提供 9.战斗的基督教 在线思维导图免费制作,点击“编辑”按钮,可对 9.战斗的基督教 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:33d168acd0cd9f767f809c7a5df86e3a

树图思维导图提供 第六章 群体传播与组织传播_副本 在线思维导图免费制作,点击“编辑”按钮,可对 第六章 群体传播与组织传播_副本 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:1672f555831e7d9a3bb2cf2fb792cb49







 上海工商
上海工商