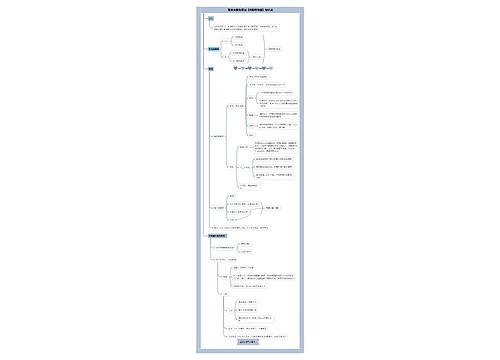
新药审批管理程序思维导图

国家药品监督管理局新修订的《药品注册管理办法》(试行)于2002年12月1日起执行。原1999年4月2日发布的《新药审批办法》、《新生物制品审批办法》、《新药保护和技术转让的规定》、《仿制药品审批办法》、《进口药品管理办法》5个行政规章同时废止。
树图思维导图提供 新药审批管理程序 在线思维导图免费制作,点击“编辑”按钮,可对 新药审批管理程序 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:c01ff3107e5d54bc9ebc7ea13e45bf99
思维导图大纲
新药审批管理程序思维导图模板大纲
国家药品监督管理局新修订的《药品注册管理办法》(试行)于2002年12月1日起执行。原1999年4月2日发布的《新药审批办法》、《新生物制品审批办法》、《新药保护和技术转让的规定》、《仿制药品审批办法》、《进口药品管理办法》5个行政规章同时废止。
我国新药研制管理的核心问题是:严把药品质量第一关,克服药品低水平重复研究、重复生产,鼓励创新、研究开发新药;在审批程序上强调了公开、公正,加快新药审批进度;在质量标准上从严要求,强调质量的可控性和标准的可操作性;药品审批与推行GMP、GLP、GCP结合起来,逐步与国际接轨。
新药审批管理的主要内容包括:
1.新药审批管理机关为国家药品监督管理局。
2.新药的分类详见《药品注册管理办法》附件。
3.新药临床前研究
(1)新药临床前研究的内容包括制备工艺(中药制剂包括原药材的来源、加工及炮制)、理化性质、纯度、检验方法、处方筛选、剂型、稳定性、质量标准、药理、毒理、动物药代动力学等研究。
(2)中药材制剂还应包括来源、生态环境、栽培(养殖)技术、采收处理、加工炮制等研究。生物制品还包括菌毒种、细胞株、生物组织等起始材料的质量标准,保存条件,稳定性及免疫学的研究等。
(3)从事新药安全性研究的实验室应符合国家药品监督管理局《药品非临床研究质量管理规范》(GLP)的要求。
4.新药临床研究新药临床研究包括临床试验和生物等效性试验。
新药临床试验分为Ⅰ、Ⅱ、Ⅲ、Ⅳ期。
Ⅰ期临床试验:初步的临床药理学及人体安全性评价试验。观察人体对于新药的耐受程度和药物代谢动力学,为制定给药方案提供依据。病例数20~30例。
Ⅱ期临床试验:随机盲法对照临床试验。对新药有效性及安全性作出初步评价,推荐临床给药剂量。病例数≥100例。
Ⅲ期临床试验:扩大的多中心临床试验。应遵循随机对照原则,进一步评价有效性、安全性。病例数≥300例。
Ⅳ期临床试验:新药上市后监测,在广泛使用条件下考察疗效和不良反应(注意罕见不良反应)。病例数>2000例。
进行新药临床研究,须符合国家药品监督管理局《药品临床试验管理规范》(GCP)的有关规定。
新药申报单位可在国家药品临床研究基地中自选临床研究负责和承担单位。
5.新药的申报与审批
(1)新药的申报与审批分为临床研究和生产上市两个阶段。
(2)省级药品监督管理部门负责初审,国家药品监督管理局复审。
(3)进行优先审评制度。属于下列情况的优先审评。①新的中药材及其制剂,中药或者天然药物中提取的有效成分及其制剂。②未在国内外获准上市的化学原料药及其制剂、生物制品。③抗艾滋病毒及用于诊断、预防艾滋病的新药,治疗恶性肿瘤、罕见病的新药。④治疗尚无有效治疗手段的疾病的新药。
(4)增加新药监测期的管理。实施条例第70条规定SDA根据保护公众健康的要求,可以对药品生产企业生产的新药设立不超过5年的检测期;在检测期内,不得批准其他企业生产和进口。
(5)非处方药的申报与审批。可申请非处方药的三种情形为:①已有国家药品标准的非处方药的生产或进口;②经国家药监局确定的非处方药改变剂型,但不改变适应症、给药剂量以及给药途径的药品;③使用国家药监局确定的非处方药活性成分组成新的复方剂型。
(6)药品补充申请的申报与审批。规定凡是变更药品批准证明文件及其所附药品标准、药品说明书、标签内载明事项的,以及改变生产工艺影响药品质量的,申请人应当提出补充申请。
⑺药品的再注册。规定药品批准证明文件有效期满后继续生产、进口的药品需进行药品的再注册。
⑻新药的批准文号格式为:
试生产批准文号国药试字X(或Z)××××××××
正式生产批准文号国药准字X(或Z)××××××××
X:代表化学药品;Z:代表中药;字母后的前4位数字为公元年号,后4位为年内顺序编号。
6.新药的质量标准新药经批准后,其质量标准为试行标准,试行期2年。
7.新药的技术转让新规定取消新药技术转让资格的审批,无须先行申请新药证书副本;检测期内的药品,不得进行技术转让;限制多家转让。
8.加强防范,加大对弄虚作假行为的处罚为保证申报新药、仿制药品的科学性、真实性,采取:①强调新药研究原始试验资料和档案必须真实、科学、规范;②加强研制单位的监督管理,增加由省级药品监督管理部门对原始试验资料进行核查,对试验场地进行考察;③加大处罚:凡在申报新药、仿制药、进口药、技术转让过程中有弄虚作假行为的,立即终止审查,并按《药品研究与申报注册违规处理办法》予以处罚。
相关思维导图模板

树图思维导图提供 江苏中慧元通生物科技股份有限公司(积分卡审批) 在线思维导图免费制作,点击“编辑”按钮,可对 江苏中慧元通生物科技股份有限公司(积分卡审批) 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:67e714395d0cbe244a68e1de56c92ed7


树图思维导图提供 行政处罚一般程序流程图 在线思维导图免费制作,点击“编辑”按钮,可对 行政处罚一般程序流程图 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:022eeedec0875f08381be4660b4dc8ab











 上海工商
上海工商