生物制品批签发管理办法的申请条例思维导图

生物制品批签发管理办法 第二章 申 请 第五条 按批签发管理的生物制品在生产、检验完成后,药品生产企业应当填写《生物制品批签发申请表》,向承担批签发检验或者审核的药品检验机构申请批签发医学教`育网搜集整理。
树图思维导图提供 生物制品批签发管理办法的申请条例 在线思维导图免费制作,点击“编辑”按钮,可对 生物制品批签发管理办法的申请条例 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:ebd6004fa74862e177cba9c561b78748
思维导图大纲
生物制品批签发管理办法的申请条例思维导图模板大纲
生物制品批签发管理办法第二章申请
第五条按批签发管理的生物制品在生产、检验完成后,药品生产企业应当填写《生物制品批签发申请表》,向承担批签发检验或者审核的药品检验机构申请批签发医学教`育网搜集整理。
第六条申请批签发的生物制品必须具有下列药品批准证明文件之一:㈠药品批准文号;㈡《进口药品注册证》或者《医药产品注册证》;㈢体外生物诊断试剂批准注册证明。
第七条申请批签发的技术要求及相关资料的格式,由中国药品生物制品检定所负责组织制定,报国家食品药品监督管理局批准并发布。
第八条申请批签发时应当提交以下资料及样品:
(一)生物制品批签发申请表;
(二)药品生产企业质量保证部门负责人签字并加盖本部门印章的批制造及检验记录摘要;
(三)检验所需的同批号样品;
(四)与制品质量相关的其他资料;
(五)进口预防用疫苗类生物制品应当同时提交生产国国家药品管理当局出具的批签发证明文件,并提供中文译本。
第九条对于效期短而且检验周期长的按照批签发管理的生物制品,经国家食品药品监督管理局确认,药品生产企业在完成生产后即可向承担批签发检验或者审核的药品检验机构申请批签发。
第十条按照批签发管理的生物制品进口时,其批签发申请按照《药品进口管理办法》的规定办理。
第十一条承担批签发检验或者审核的药品检验机构接到生物制品批签发申请后,应当在5日内决定是否受理。不予受理的,予以退审,并说明理由。
申请材料不齐全或者不符合法定形式的,承担批签发检验或者审核的药品检验机构应当在5日内一次性告知申请人需要补正的全部内容,逾期不告知的,自收到申请材料之日起即为受理。
申请材料存在可以当场更正的错误的,应当允许申请人当场更正。
相关思维导图模板


树图思维导图提供 904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查 在线思维导图免费制作,点击“编辑”按钮,可对 904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:10b9a8a2dd2fb4593f8130ef16c320fc
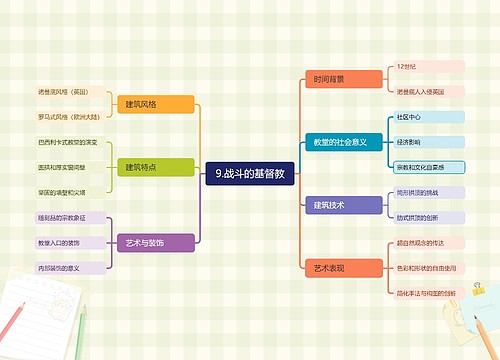

树图思维导图提供 9.战斗的基督教 在线思维导图免费制作,点击“编辑”按钮,可对 9.战斗的基督教 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:33d168acd0cd9f767f809c7a5df86e3a









 上海工商
上海工商