无机化学:氢氧化物详述!思维导图

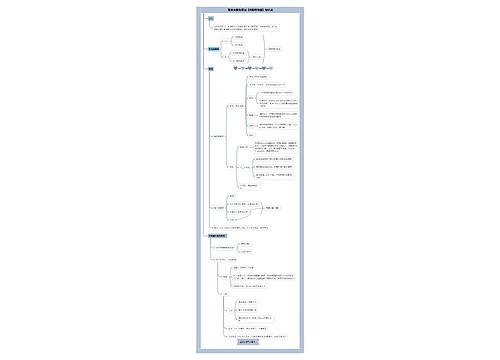
有关无机化学,以下是小编整理的“无机化学:氢氧化物详述!”,具体内容如下,请查看! 除外均可由相应的氧化物与水反应而得,NaOH亦可在溶液中由下法制取: Na2CO3+Ca(OH)2=2NaOH+CaCO3↓ 碱金属和碱土金属的氢氧化物都是白色固体,它们在空气中易吸水而潮解,故固体NaOH、Ca(OH)2常用做干燥剂。
树图思维导图提供 无机化学:氢氧化物详述! 在线思维导图免费制作,点击“编辑”按钮,可对 无机化学:氢氧化物详述! 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:f9d43c579951568afc20b98a4ff5158a
思维导图大纲
无机化学:氢氧化物详述!思维导图模板大纲
除外均可由相应的氧化物与水反应而得,NaOH亦可在溶液中由下法制取:
Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
碱金属和碱土金属的氢氧化物都是白色固体,它们在空气中易吸水而潮解,故固体NaOH、Ca(OH)2常用做干燥剂。强碱,对纤维和皮肤有强烈的腐蚀作用,所以称它们为苛性碱。
一、溶解度
ⅠA:S大,ⅡA:S小。从上至下,S增大,因为U减小,易拆开。
碱金属的氢氧化物在水中都是易溶的(其中LiOH的溶解度稍小些),溶解时还放出大量的热。碱土金属的氢氧化物的溶解度则较小,其中Be(OH)2和Mg(OH)2是难溶的氢氧化物。碱土金属的氢氧化物的溶解度列入表12-14中。由表中数据可见,对碱土金属来说,由Be(OH)2到Ba(OH)2溶解度依次增大。这是由于随着金属离子半径的增大,阳、阴离子之间的作用力逐渐减小,容易为水分子所解离的缘故。
二、碱性:从上至下,碱性增加,ⅠA>ⅡA
碱金属和碱土金属的氢氧化物中,除Be(OH)2为两性氢氧化物外,其他氢氧化物都是强碱或中强碱……这两族元素氢氧化物碱性的递变次序如下:
LiOH
中强碱强碱强碱强碱强碱
Be(OH)2
两性中强碱强碱强碱强碱
同一主族的金属氢氧化物,从上到下碱性增强;
同一周期的金属氢氧化物,从右到左碱性增强。
氢氧化钠能腐蚀玻璃,实验室盛氢氧化钠溶液的试剂瓶,应用橡皮塞,而不能用玻璃塞,否则存放时间较长,NaOH就和瓶口玻璃中的主要成分SiO2反应而生成粘性的Na2SiO3而把玻璃塞和瓶口粘结在一起。
SiO2+2NaOH===Na2SiO3+H2O
在化学分析工作中需要不含Na2CO3的NaOH溶液,可先配制NaOH的饱和溶液,Na2CO3因不溶于饱和的NaOH溶液而沉淀析出,静置取上层清液,用煮沸后冷却的新鲜水稀释到所需的浓度即可。
因其能溶解某些金属氧化物、非金属氧化物,在工业生产和分析工作中常用于分解矿石。熔融的氢氧化钠腐蚀性很强,工业上熔化氢氧化钠一般用铸铁容器,在实验室可用银或镍的器皿。
相关思维导图模板
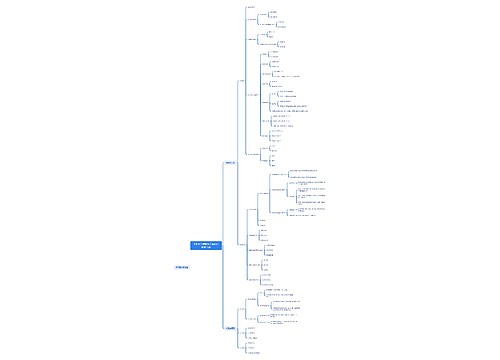

树图思维导图提供 无机化学铜副族元素和锌副族元素 在线思维导图免费制作,点击“编辑”按钮,可对 无机化学铜副族元素和锌副族元素 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:87067f88750a69381354986bc3728d69


树图思维导图提供 无机化学氢和稀有气体 在线思维导图免费制作,点击“编辑”按钮,可对 无机化学氢和稀有气体 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:4bfd525b223daa533c7619d3d760568e












 上海工商
上海工商