中华人民共和国药品管理法释义:第30条思维导图
核心内容:《中华人民共和国药品管理法》第30条应该怎样释义呢?药品管理法第30条规定的是药物的非临床安全性评价研究机构和临床试验机构必须分别执行有关管理规范。树图网编辑为您详细介绍关于药品管理法第30条的释义。
树图思维导图提供 中华人民共和国药品管理法释义:第30条 在线思维导图免费制作,点击“编辑”按钮,可对 中华人民共和国药品管理法释义:第30条 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:2a9d0e91ce28029fd69bf95278b9f21c
思维导图大纲
中华人民共和国药品管理法释义:第30条思维导图模板大纲
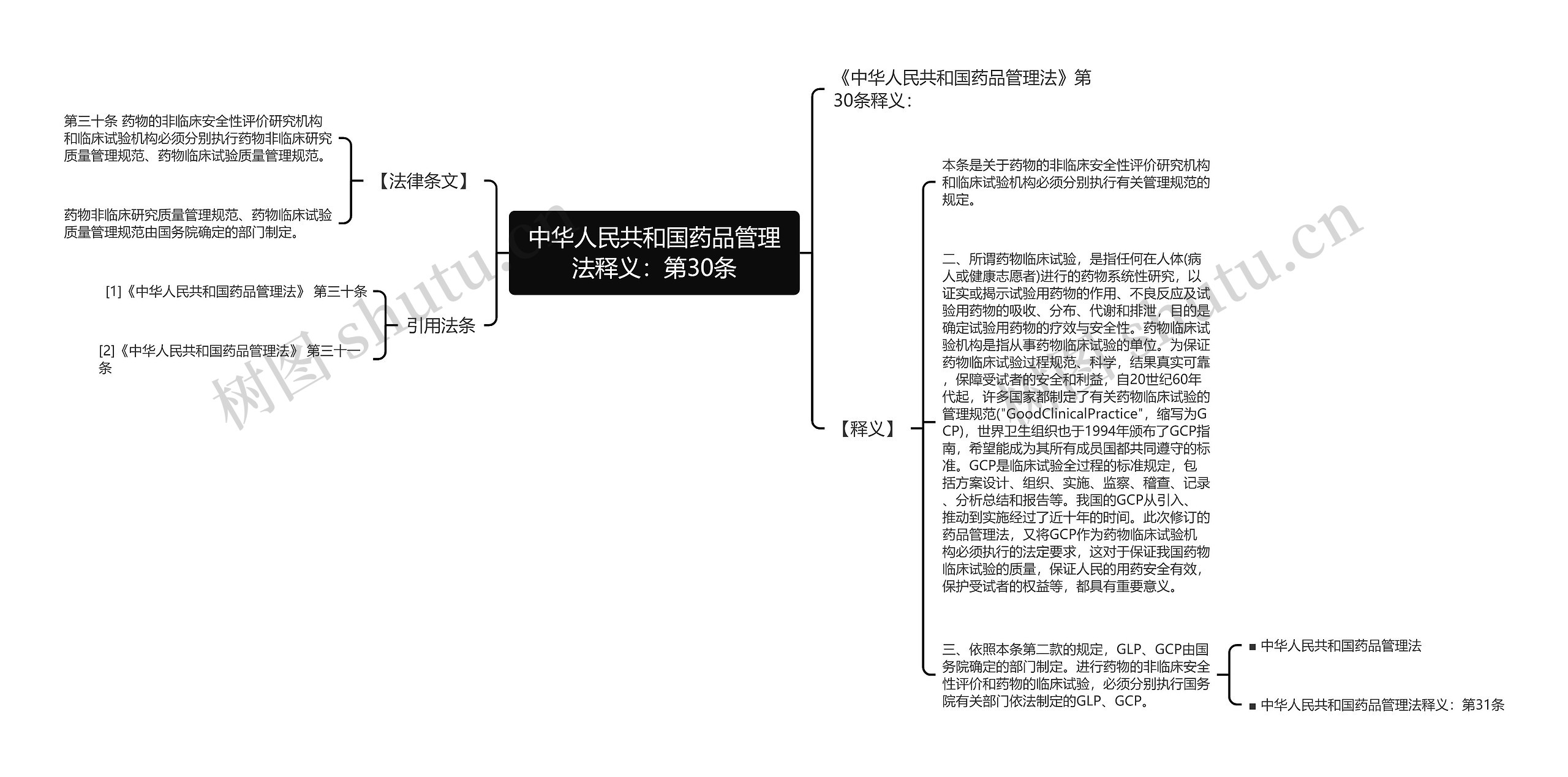
《中华人民共和国药品管理法》第30条释义:
【法律条文】
第三十条 药物的非临床安全性评价研究机构和临床试验机构必须分别执行药物非临床研究质量管理规范、药物临床试验质量管理规范。
药物非临床研究质量管理规范、药物临床试验质量管理规范由国务院确定的部门制定。
【释义】
本条是关于药物的非临床安全性评价研究机构和临床试验机构必须分别执行有关管理规范的规定。
二、所谓药物临床试验,是指任何在人体(病人或健康志愿者)进行的药物系统性研究,以证实或揭示试验用药物的作用、不良反应及试验用药物的吸收、分布、代谢和排泄,目的是确定试验用药物的疗效与安全性。药物临床试验机构是指从事药物临床试验的单位。为保证药物临床试验过程规范、科学,结果真实可靠,保障受试者的安全和利益,自20世纪60年代起,许多国家都制定了有关药物临床试验的管理规范("GoodClinicalPractice",缩写为GCP),世界卫生组织也于1994年颁布了GCP指南,希望能成为其所有成员国都共同遵守的标准。GCP是临床试验全过程的标准规定,包括方案设计、组织、实施、监察、稽查、记录、分析总结和报告等。我国的GCP从引入、推动到实施经过了近十年的时间。此次修订的药品管理法,又将GCP作为药物临床试验机构必须执行的法定要求,这对于保证我国药物临床试验的质量,保证人民的用药安全有效,保护受试者的权益等,都具有重要意义。
三、依照本条第二款的规定,GLP、GCP由国务院确定的部门制定。进行药物的非临床安全性评价和药物的临床试验,必须分别执行国务院有关部门依法制定的GLP、GCP。
■ 中华人民共和国药品管理法
■ 中华人民共和国药品管理法释义:第31条
引用法条
[1]《中华人民共和国药品管理法》 第三十条
[2]《中华人民共和国药品管理法》 第三十一条
相关思维导图模板


树图思维导图提供 904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查 在线思维导图免费制作,点击“编辑”按钮,可对 904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:10b9a8a2dd2fb4593f8130ef16c320fc

树图思维导图提供 第六章 群体传播与组织传播_副本 在线思维导图免费制作,点击“编辑”按钮,可对 第六章 群体传播与组织传播_副本 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:1672f555831e7d9a3bb2cf2fb792cb49










 上海工商
上海工商