蛋白质的结构与功能脑图思维导图
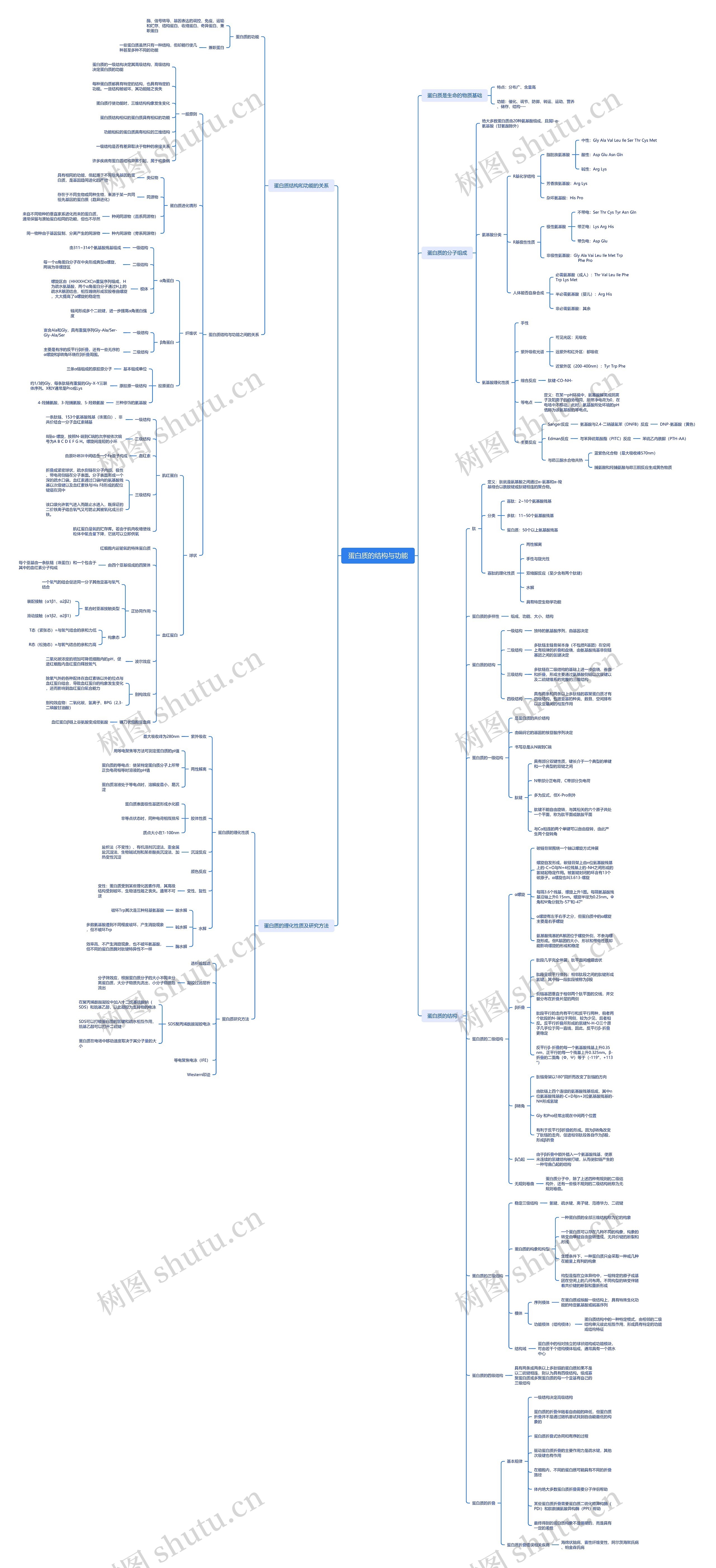
分子构成,蛋白质结构,理化性质和研究方法全内容脑图
树图思维导图提供 蛋白质的结构与功能脑图 在线思维导图免费制作,点击“编辑”按钮,可对 蛋白质的结构与功能脑图 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:0d0b84ff51772b09f8835cbdc8239aa6
思维导图大纲
蛋白质的结构与功能思维导图模板大纲
蛋白质是生命的物质基础
特点:分布广、含量高
功能:催化、调节、防御、转运、运动、营养、储存、结构······
蛋白质的分子组成
绝大多数蛋白质由20种氨基酸组成,且属l-α-氨基酸(甘氨酸除外)
氨基酸分类
R基化学结构
脂肪族氨基酸
中性:Gly Ala Val Leu Ile Ser Thr Cys Met
酸性:Asp Glu Asn Gln
碱性:Arg Lys
芳香族氨基酸:Arg Lys
杂环氨基酸:His Pro
R基极性性质
极性氨基酸
不带电:Ser Thr Cys Tyr Asn Gln
带正电:Lys Arg His
带负电:Asp Glu
非极性氨基酸:Gly Ala Vai Leu Ile Met Trp Phe Pro
人体能否自身合成
必需氨基酸(成人):Thr Val Leu Ile Phe Trp Lys Met
半必需氨基酸(婴儿):Arg His
非必需氨基酸:其余
氨基酸理化性质
手性
紫外吸收光谱
可见光区:无吸收
远紫外和红外区:都吸收
近紫外区(200-400nm):Tyr Trp Phe
缩合反应
肽键-CO-NH-
等电点
定义:在某一pH环境中,氨基酸解离成阴离子及阳离子的趋势相同,所带净电荷为0,在电场中不移动。此时,氨基酸所处环境的pH值称为该氨基酸的等电点。
主要反应
Sanger反应
氨基酸与2,4-二硝基氟苯(DNFB)反应
DNP-氨基酸(黄色)
Edman反应
与苯异硫氰酸酯(PITC)反应
苯硫乙内酰脲(PTH-AA)
与茚三酮水合物共热
蓝紫色化合物(最大吸收峰570nm)
脯氨酸和羟脯氨酸与茚三酮反应生成黄色物质
蛋白质的结构
肽
定义:肽就是氨基酸之间通过α-氨基和α-羧基缩合以酰胺键或肽键相连的聚合物。
分类
寡肽:2~10个氨基酸残基
多肽:11~50个氨基酸残基
蛋白质:50个以上氨基酸残基
寡肽的理化性质
两性解离
手性与旋光性
双缩脲反应(至少含有两个肽键)
水解
具有特定生物学功能
蛋白质的多样性
组成、功能、大小、结构
蛋白质的结构
一级结构
独特的氨基酸序列,由基因决定
二级结构
多肽链主链骨架本身(不包括R基团)在空间上有规律的折叠和盘绕,由氨基酸残基非侧链基团之间的氢键决定
三级结构
多肽链在二级结构的基础上进一步盘绕、卷曲和折叠,形成主要通过氨基酸侧链以次级键以及二硫键维系的完整的三维结构
四级结构
具有两条和两条以上多肽链的寡聚蛋白质才有四级结构。包括亚基的种类、数目、空间排布以及亚基间的相互作用
蛋白质的一级结构
是蛋白质的共价结构
由编码它的基因的核苷酸序列决定
书写总是从N端到C端
肽键
具有部分双键性质,键长介于一个典型的单键和一个典型的双键之间
N带部分正电荷,C带部分负电荷
多为反式,但X-Pro例外
肽键不能自由旋转,与其相关的六个原子共处一个平面,称为肽平面或酰胺平面
与Cα相连的两个单键可以自由旋转,由此产生两个旋转角
蛋白质的二级结构
α螺旋
碳链骨架围绕一个轴以螺旋方式伸展
螺旋自发形成,碳链骨架上由n位氨基酸残基上的-C=O与N+4位残基上的-NH之间形成的氢键起稳定作用。被氢键封闭的环含有13个碳原子。α螺旋也叫3.613-螺旋
每隔3.6个残基,螺旋上升1圈。每隔氨基酸残基沿轴上升0.15nm。螺旋半径为0.23nm。Φ角和Ψ角分别为-57°和-47°
α螺旋有左手右手之分,但蛋白质中的α螺旋主要是右手螺旋
氨基酸残基的R基团位于螺旋外侧,不参与螺旋形成。但R基团的大小、形状和带电性质却能影响螺旋的形成和稳定
β折叠
肽段几乎完全伸展,肽平面间成锯齿状
肽段呈现平行排列,相邻肽段之间的肽键形成氢键,其中每一段肽段被称为β股
侧链基团垂直于相邻两个肽平面的交线,并交替分布在折叠片层的两侧
肽段平行的走向有平行和反平行两种,前者两个肽段的N-端位于同侧,较为少见,后者相反。反平行折叠所形成的氢键N-H-O三个原子几乎位于同一直线,因此,反平行β-折叠更稳定
反平行β-折叠的每一个氨基酸残基上升0.35nm,正平行的每一个残基上升0.325nm。β-折叠的二面角(Φ,Ψ)等于(-119°,+113°)
β转角
肽链骨架以180°回折而改变了肽链的方向
由肽链上四个连续的氨基酸残基组成,其中n位氨基酸残基的-C=D与n+3位氨基酸残基的-NH形成氢键
Gly 和Pro经常出现在中间两个位置
有利于反平行β折叠的形成。因为β转角改变了肽链的走向,促进相邻肽段各自作为β股,形成β折叠
β凸起
由于β折叠中额外插入一个氨基酸残基,使原来连续的氢键结构被打破,从而使肽链产生的一种弯曲凸起的结构
无规则卷曲
蛋白质分子中,除了上述四种有规则的二级结构外,还有一些极不规则的二级结构统称为无规则卷曲。
蛋白质的三级结构
稳定三级结构
氢键、疏水键、离子键、范德华力、二硫键
蛋白质的构象和构型
一种蛋白质的全部三维结构称为它的构象
一个蛋白质可以存在几种不同的构象,构象的转变由单键自由旋转造成,无共价键的断裂和形成
生理条件下,一种蛋白质只会采取一种或几种在能量上有利的构象
构型是指在立体异构中,一组特定的原子或基团在空间上的几何布局。不同构型的转变伴随着共价键的断裂和重新形成
模体
序列模体
在蛋白质或核酸一级结构上,具有特殊生化功能的特定氨基酸或碱基序列
功能模体(结构模体)
蛋白质结构中的一种特定模式,由相邻的二级结构单元彼此相互作用,形成具有特定的功能或结构特征
结构域
蛋白质中的相对独立的球状结构或功能模块,可由若干个结构模体组成,通常具有一个疏水中心
蛋白质的四级结构
具有两条或两条以上多肽链的蛋白质如果不是以二硫键相连,则认为具有四级结构。组成寡聚蛋白质或多聚蛋白质的每一个亚基有自己的三级结构
蛋白质的折叠
基本规律
一级结构决定高级结构
蛋白质的折叠伴随着自由能的降低,但蛋白质折叠并不是通过随机尝试找到自由能最低的构象的
蛋白质折叠式协同和有序的过程
驱动蛋白质折叠的主要作用力是疏水键,其他次级键也有作用
在细胞内,不同的蛋白质可能具有不同的折叠路径
体内绝大多数蛋白质折叠需要分子伴侣帮助
某些蛋白质折叠需要蛋白质二硫化物异构酶(PDI)和肽酰脯氨酸异构酶(PPI)帮助
最终得到的蛋白质构象不是僵硬的,而是具有一定的柔性
蛋白质折叠错误相关疾病
海绵状脑病、囊性纤维变性、阿尔茨海默氏病、帕金森氏病
蛋白质结构和功能的关系
蛋白质的功能
酶、信号转导、基因表达的调控、免疫、运输和贮存、结构蛋白、收缩蛋白、奇异蛋白、兼职蛋白
兼职蛋白
一些蛋白质虽然只有一种结构,但却能行使几种甚至多种不同的功能
蛋白质结构与功能之间的关系
一般原则
蛋白质的一级结构决定其高级结构,高级结构决定蛋白质的功能
每种蛋白质都具有特定的结构,也具有特定的功能。一旦结构被破坏,其功能随之丧失
蛋白质行使功能时,三维结构构象发生变化
蛋白质结构相似的蛋白质具有相似的功能
功能相似的蛋白质具有相似的三维结构
一级结构是否有差异取决于物种的亲缘关系
许多疾病有蛋白质结构异常引起,属于构象病
蛋白质进化情形
类似物
具有相同的功能,但起源于不同祖先基因的蛋白质,是基因趋同进化的产物
同源物
存在于不同生物或同种生物,来源于某一共同祖先基因的蛋白质(趋异进化)
种间同源物(直系同源物)
来自不同物种的垂直家系进化而来的蛋白质,通常保留与原始蛋白相同的功能,但也不尽然
种内同源物(旁系同源物)
同一物种由于基因复制、分离产生的同源物
纤维状
α角蛋白
一级结构
由311~314个氨基酸残基组成
二级结构
每一个α角蛋白分子在中央形成典型α螺旋,两端为非螺旋区
模体
螺旋区由(HHXXHCXC)n重复序列组成,H为疏水氨基酸,两个α角蛋白分子通过H上的疏水R基团结合,相互缠绕形成双股卷曲螺旋,大大提高了α螺旋的稳定性
链间形成多个二硫键,进一步提高α角蛋白强度
β角蛋白
一级结构
富含Ala和Gly,具有重复序列Gly-Ala/Ser-Gly-Ala/Ser
二级结构
主要是有序的反平行β折叠,还有一些无序的α螺旋和β转角环绕在β折叠周围。
胶原蛋白
基本组成单位
三条α链组成的原胶原分子
原胶原一级结构
约1/3的Gly,每条肽链有重复的Gly-X-Y三联体序列。X和Y通常是Pro或Lys
三种修饰的氨基酸
4-羟脯氨酸、3-羟脯氨酸、5-羟赖氨酸
球状
肌红蛋白
一级结构
一条肽链、153个氨基酸残基(珠蛋白)、非共价结合一分子血红素辅基
二级结构
8段α-螺旋,按照N-端到C端的次序被依次编号为A B C D E F G H。螺旋间是短的小环
血红素
由原卟啉Ⅸ中间结合一个Fe原子构成
三级结构
折叠成紧密球状,疏水侧链在分子内部,极性、带电荷侧链在分子表面。分子表面形成一个深的疏水口袋。血红素通过口袋内的氨基酸残基以次级键以及血红素铁与His F8形成的配位键藏在洞中
该口袋允许氧气进入而阻止水进入,既保证的二价铁离子结合氧气又可防止其被氧化成三价铁。
肌红蛋白是氧的贮存库。若由于肌肉收缩使线粒体中氧含量下降,它就可以立即供氧
血红蛋白
红细胞内运输氧的特殊蛋白质
由四个亚基组成的四聚体
每个亚基由一条肽链(珠蛋白)和一个包含于其中的血红素分子构成
正协同作用
一个氧气的结合促进同一分子其他亚基与氧气结合
氧合时亚基接触类型
装配接触(α1β1、α2β2)
滑动接触(α1β2、α2β1)
构象态
T态(紧张态)=与氧气结合的亲和力低
R态(松弛态)=与氧气结合的亲和力高
波尔效应
二氧化碳浓度的增加可降低细胞内的pH,促进红细胞内血红蛋白释放氧气
别构效应
除氧气外的各种配体在血红素铁以外的位点与血红蛋白结合,导致血红蛋白的构象发生变化,进而影响到血红蛋白氧合能力
别构效应物:二氧化碳、氢离子、BPG(2,3-二磷酸甘油酸)
镰刀状细胞贫血病
血红蛋白β链上谷氨酸变成缬氨酸
蛋白质的理化性质及研究方法
蛋白质的理化性质
紫外吸收
最大吸收峰为280nm
两性解离
用等电聚焦等方法可测定蛋白质的pI值
蛋白质的等电点:使某特定蛋白质分子上所带正负电荷相等时溶液的pH值
蛋白质溶液处于等电点时,溶解度最小,易沉淀
胶体性质
蛋白质表面极性基团形成水化膜
非等点状态时,同种电荷相互排斥
质点大小在1-100nm
沉淀反应
盐析法(不变性)、有机溶剂沉淀法、重金属盐沉淀法、生物碱试剂和某些酸类沉淀法、加热变性沉淀
颜色反应
变性、复性
变性:蛋白质受到某些理化因素作用,其高级结构受到破坏,生物活性随之丧失。通常不可逆
水解
酸水解
破坏Trp其次是三种羟基氨基酸
碱水解
多数氨基酸遭到不同程度破坏,产生消旋现象,但不破坏Trp
酶水解
效率高、不产生消旋现象,也不破坏氨基酸,但不同的蛋白质酶对肽键特异性不一样
蛋白质研究方法
透析或超滤
凝胶过滤层析
分子筛效应,根据蛋白质分子的大小不同来分离蛋白质,大分子物质先流出,小分子物质后流出
SDS聚丙烯酰胺凝胶电泳
在聚丙烯酰胺凝胶中加入十二烷基硫酸钠(SDS)和巯基乙醇,以此凝胶为支持物的电泳
SDS可以打破蛋白质的氢键和疏水相互作用,巯基乙醇可以打开二硫键
蛋白质在电场中移动速度取决于其分子量的大小
等电聚焦电泳(IFE)
Western印迹
相关思维导图模板


树图思维导图提供 904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查 在线思维导图免费制作,点击“编辑”按钮,可对 904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:10b9a8a2dd2fb4593f8130ef16c320fc

树图思维导图提供 二手书销售平台新航标 在线思维导图免费制作,点击“编辑”按钮,可对 二手书销售平台新航标 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:a92403b70afada50cf4fa4f56e0981c9









 上海工商
上海工商