化学基础知识点初中思维导图

大家最不陌生的就是知识点吧!知识点也不一定都是文字,数学的知识点除了定义,同样重要的公式也可以理解为知识点。
树图思维导图提供 化学基础知识点初中 在线思维导图免费制作,点击“编辑”按钮,可对 化学基础知识点初中 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:120dd27e2a67f2c7dce275dad3804c79
思维导图大纲
化学基础知识点初中思维导图模板大纲
大家最不陌生的就是知识点吧!知识点也不一定都是文字,数学的知识点除了定义,同样重要的公式也可以理解为知识点。为了方便大家学习借鉴,下面树图网精心准备了化学基础知识点初中内容,欢迎使用学习!
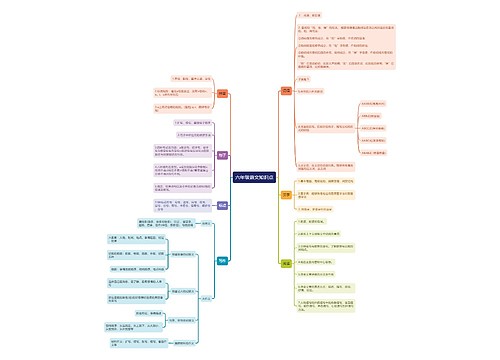
化学基础知识点初中
常 见 物 质 的 分 类
单质:非惰性气体一般由两个原子组成:F2,O2,H2,Cl2惰性气体:一般由一个原子组成:He,Ne,Ar,Kr,Xe化合物:氢化物居多:H2S,HCl,H3P,HF,HBr,HI
常 见 物 质 的 颜 色
固体的颜色
1.红色固体:铜,氧化铁,氧化汞
2.绿色固体:碱式碳酸铜(铜绿),七水硫酸亚铁(绿矾)
3.蓝色固体:氢氧化铜,硫酸铜晶体
4.紫黑色固体:高锰酸钾
5.淡黄色固体:硫磺
6.无色固体:冰,干冰,金刚石
7.银白色固体:银,铁,镁,铝,汞等金属
8.黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧9.化三铁,(碳黑,活性炭)
10.红褐色固体:氢氧化铁
11.白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁
液体的颜色
1.凡含Cu2+的溶液呈蓝色;
2.凡含Fe2+的溶液呈浅绿色;
3.凡含Fe3+的溶液呈棕黄色,其余溶液一般不无色。
4.无色液体:水,双氧水
5.蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液
6.浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液
7.黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液
8.紫红色溶液:高锰酸钾溶液
9.紫色溶液:石蕊溶液
气体的颜色
1.红棕色气体:二氧化氮
2.黄绿色气体:氯气
3.无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢气体等大多数气体。
物 质 的 检 验
(一) 、气体的检验
1.氧气:带火星的木条放入瓶中,若木条复燃,则是氧气.
2.氢气:在玻璃尖嘴点燃气体,罩一干冷小烧杯,观察杯壁是否有水滴,往烧杯中倒入澄清的石灰水,若不变浑浊,则是氢气.
3.二氧化碳:通入澄清的石灰水,若变浑浊则是二氧化碳.
4.氨气:湿润的紫红色石蕊试纸,若试纸变蓝,则是氨气.
5.水蒸气:通过无水硫酸铜,若白色固体变蓝,则含水蒸气.
(二)、离子的检验
1.氢离子:滴加紫色石蕊试液/加入锌粒
2.氢氧根离子:酚酞试液/硫酸铜溶液
3.碳酸根离子:稀盐酸和澄清的石灰水
4.氯离子:硝酸银溶液和稀硝酸,若产生白色沉淀,则是氯离子
5.硫酸根离子:硝酸钡溶液和稀硝酸/先滴加稀盐酸再滴入氯化钡
6.铵根离子:氢氧化钠溶液并加热,把湿润的红色石蕊试纸放在试管口
7.铜离子:滴加氢氧化钠溶液,若产生蓝色沉淀则是铜离子
8.铁离子:滴加氢氧化钠溶液,若产生红褐色沉淀则是铁离子
(三)、相关例题
1.如何检验NaOH是否变质:滴加稀盐酸,若产生气泡则变质
2.检验生石灰中是否含有石灰石:滴加稀盐酸,若产生气泡则含有石灰石
3.检验NaOH中是否含有NaCl:先滴加足量稀硝酸,再滴加AgNO3溶液,若产生白色沉淀,则含有NaCl。
4.检验三瓶试液分别是稀HNO3,稀HCl,稀H2SO4?
向三只试管中分别滴加Ba(NO3)2溶液,若产生白色沉淀,则是稀H2SO4;再分别滴加AgNO3溶液,若产生白色沉淀则是稀HCl,剩下的是稀HNO3
5.淀粉:加入碘溶液,若变蓝则含淀粉。
6.葡萄糖:加入新制的氢氧化铜,若生成砖红色的氧化亚铜沉淀,就含葡萄糖。
物 质 的 溶 解 性
(一)盐的溶解性
1.含有钾、钠、硝酸根、铵根的物质都溶于水
2.含Cl的化合物只有AgCl不溶于水,其他都溶于水;
3.含SO42-的化合物只有BaSO4不溶于水,其他都溶于水。
4.含CO32-的物质只有K2CO3、Na2CO3、(NH4)2CO3溶于水,其他都不溶于水
(二)碱的溶解性
1.溶于水的碱有:氢氧化钡、氢氧化钾、氢氧化钙、氢氧化钠和氨水,其他碱不溶于水。难溶性碱中Fe(OH)3是红褐色沉淀,Cu(OH)2是蓝色沉淀,其他难溶性碱为白色。(包括Fe(OH)2)注意:沉淀物中AgCl和BaSO4不溶于稀硝酸,
2.其他沉淀物能溶于酸。如:Mg(OH)2 CaCO3 BaCO3Ag2CO3等
3.大部分酸及酸性氧化物能溶于水,(酸性氧化物+水→酸)大部分碱性氧化物不溶于水,能溶的有:氧化钡、氧化钾、氧化钙、氧化钠(碱性氧化物+水→碱)
常 见 物 质 的 俗 称
1.氯化钠(NaCl):食盐
2.碳酸钠(Na2CO3):纯碱,苏打,口碱
3.氢氧化钠(NaOH):火碱,烧碱,苛性钠
4.氧化钙(CaO):生石灰
5.氢氧化钙(Ca(OH)2):熟石灰,消石灰
6.二氧化碳固体(CO2):干冰
7.氢氯酸(HCl):盐酸
8.碱式碳酸铜(Cu2(OH)2CO3):铜绿
9.硫酸铜晶体(CuSO4.5H2O):蓝矾,胆矾
10.甲烷(CH4):沼气
11.乙醇(C2H5OH):酒精
12.乙酸(CH3COOH):醋酸
13.过氧化氢(H2O2):双氧水
14.汞(Hg):水银
15.碳酸氢钠(NaHCO3):小苏打
常 见 混 合 物 的 重 要 成 分
1.空气:氮气(N2)和氧气(O2)
2.水煤气:一氧化碳(CO)和氢气(H2)
3.煤气:一氧化碳(CO)
4.天然气:甲烷(CH4)
5.石灰石/大理石:(CaCO3)
6.生铁/钢:(Fe)
7.木炭/焦炭/炭黑/活性炭:(C)
8.铁锈:(Fe2O3)
物 质 的 除 杂 方 法
1.CO2(CO):把气体通过灼热的氧化铜,
2.CO(CO2):通过足量的氢氧化钠溶液
3.H2(水蒸气):通过浓硫酸/通过氢氧化钠固体
4.CuO(C):在空气中(在氧气流中)灼烧混合物
5.Cu(Fe):加入足量的稀硫酸
6.Cu(CuO):加入足量的稀硫酸
7.FeSO4(CuSO4):加入足量的铁粉
8.NaCl(Na2CO3):加入足量的盐酸
9.NaCl(Na2SO4):加入足量的氯化钡溶液
10.NaCl(NaOH):加入足量的盐酸
11.NaOH(Na2CO3):加入足量的氢氧化钙溶液
12.NaCl(CuSO4):加入足量的氢氧化钡溶液
13.NaNO3(NaCl):加入足量的硝酸银溶液
14.NaCl(KNO3):蒸发溶剂
15.KNO3(NaCl):冷却热饱和溶液。
16.CO2(水蒸气):通过浓硫酸。
初中化学必背方程式
一. 物质与氧气的反应:
(1)单质与氧气的反应:
1. 镁在空气中燃烧:2Mg + O2 点燃 2MgO
2. 铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O4
3. 铜在空气中受热:2Cu + O2 加热 2CuO
4. 铝在空气中燃烧:4Al + 3O2 点燃 2Al2O3
5. 氢气中空气中燃烧:2H2 + O2点燃 2H2O
6. 红磷在空气中燃烧:4P + 5O2 点燃 2P2O5
7. 硫粉在空气中燃烧: S + O2 点燃 SO2
8. 碳在氧气中充分燃烧:C + O2 点燃 CO2
9. 碳在氧气中不充分燃烧:2C + O2 点燃 2CO
(2)化合物与氧气的反应:
10. 一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO2
11. 甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O
12. 酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O
二.几个分解反应:
13. 水在直流电的作用下分解:2H2O 通电 2H2↑+ O2 ↑
14. 加热碱式碳酸铜:Cu2(OH)2CO3 加热2CuO + H2O + CO2↑
15. 加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl + 3O2 ↑
16. 加热高锰酸钾:2KMnO4 加热K2MnO4 + MnO2 + O2↑
17. 碳酸不稳定而分解:H2CO3 === H2O + CO2↑
18. 高温煅烧石灰石:CaCO3 高温CaO + CO2↑
三.几个氧化还原反应:
19. 氢气还原氧化铜:H2 + CuO 加热 Cu + H2O
20. 木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑
21. 焦炭还原氧化铁:3C+ 2Fe2O3 高温4Fe + 3CO2↑
22. 焦炭还原四氧化三铁:2C+ Fe3O4 高温3Fe + 2CO2↑
23. 一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO2
24. 一氧化碳还原氧化铁:3CO+ Fe2O3 高温2Fe + 3CO2
25. 一氧化碳还原四氧化三铁:4CO+ Fe3O4 高温3Fe + 4CO2
四.单质、氧化物、酸、碱、盐的相互关系
(1)金属单质 + 酸 -------- 盐 + 氢气 (置换反应)
26. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑
27. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑
28. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑
29. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3+3H2↑
30. 锌和稀盐酸Zn + 2HCl=== ZnCl2 + H2↑
31. 铁和稀盐酸Fe + 2HCl=== FeCl2 + H2↑
32. 镁和稀盐酸Mg+ 2HCl=== MgCl2 + H2↑
33. 铝和稀盐酸2Al + 6HCl == 2AlCl3+ 3H2↑
(2)金属单质 + 盐(溶液) ------- 另一种金属 + 另一种盐
34. 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu
35. 锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu
36. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 +Hg
(3)碱性氧化物 +酸 -------- 盐 + 水
37. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O
38. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3+ 3H2O
39. 氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O
40. 氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O
41. 氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O
42. 氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O
(4)酸性氧化物 +碱 -------- 盐 + 水
43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O
44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O
45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O
46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O
47.消石灰吸收二氧化硫:Ca(OH)2+ SO2 ==== CaSO3 ↓+H2O
(5)酸 + 碱 --------盐 + 水
48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O
49.盐酸和氢氧化钾反应:HCl + KOH==== KCl +H2O
50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ====CuCl2 + 2H2O
51.盐酸和氢氧化钙反应:2HCl +Ca(OH)2 ==== CaCl2 + 2H2O
52.盐酸和氢氧化铁反应:3HCl +Fe(OH)3 ==== FeCl3 + 3H2O
53.氢氧化铝药物治疗胃酸过多:3HCl+ Al(OH)3 ==== AlCl3 + 3H2O
54.硫酸和烧碱反应:H2SO4+ 2NaOH ==== Na2SO4 + 2H2O
55.硫酸和氢氧化钾反应:H2SO4+ 2KOH ==== K2SO4 + 2H2O
56.硫酸和氢氧化铜反应:H2SO4+ Cu(OH)2 ==== CuSO4 + 2H2O
57.硫酸和氢氧化铁反应:3H2SO4+ 2Fe(OH)3==== Fe2(SO4)3 + 6H2O
58.硝酸和烧碱反应:HNO3+NaOH ==== NaNO3 +H2O
(6)酸 + 盐-------- 另一种酸 + 另一种盐
59.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑
61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑
62.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓ + HNO3
63.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4+ H2O + CO2↑
64.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4↓+2HCl
(7)碱 + 盐-------- 另一种碱 + 另一种盐
65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓ +Na2SO4
66.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓ +3NaCl
67.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓ +2NaCl
68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓ +2NaCl
69. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+2NaOH
(8)盐 + 盐----- 两种新盐
70.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 ==== AgCl↓ + NaNO3
71.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓ +2NaCl
五.其它反应:
72.二氧化碳溶解于水:CO2 + H2O === H2CO3
73.生石灰溶于水:CaO + H2O === Ca(OH)2
74.氧化钠溶于水:Na2O + H2O==== 2NaOH
75.三氧化硫溶于水:SO3 + H2O==== H2SO4
76.硫酸铜晶体受热分解:CuSO4·5H2O 加热 CuSO4 + 5H2O
77.无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4·5H2O
初中化学要讲究方法记忆
重复是记忆的基本方法
对一些化学概念,如元素符号、化学式、某些定义等反复记忆,多次加深印象,是有效记忆最基本的方法。
理解是记忆的前提
所谓理解,就是对某一问题不但能回答"是什么",而且能回答"为什么"。例如,知道某物质的结构后,还应理解这种结构的意义。这就容易记清该物质的性质,进而记忆该物质的制法与用途。所以,对任何问题都要力求在理解的基础上进行记忆。
谐音记忆法
对有些知识,我们可以用谐音法来加以记忆。例如,元素在地壳中的含量顺序:氧、硅、铝、铁、钙、钠、钾、镁、氢可以编成这样的谐音:一个姓杨(氧)的姑(硅)娘,买了一个(铝)(铁)合金的锅盖(钙),拿(钠)回家(钾),又美(镁)又轻(氢)。
化学基础知识点初中相关文章:
★ 初中化学单元知识点总结最新2022
★ 人教版初中化学知识点总结最新大全
★ 2021初中化学中考必背考点
★ 初三化学知识点重点全汇总
★ 2021初中化学基本概念和原理知识点整理
★ 初中化学元素基础知识有哪些
★ 初中化学之三的知识点全整理
★ 初三化学基本概念知识整理大全2021
★ 2021初三化学必考知识点整理
相关思维导图模板

树图思维导图提供 Linux 网络基础知识 在线思维导图免费制作,点击“编辑”按钮,可对 Linux 网络基础知识 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:199680f0e48eac8a1aeaadb90447d4f4

树图思维导图提供 抓住重点 在线思维导图免费制作,点击“编辑”按钮,可对 抓住重点 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:4c49e4799ddf94a339c56e46eb96a826







 上海工商
上海工商