2022初中化学非金属单质的化学性质知识点思维导图

2022初中化学非金属单质的化学性质知识点。新东方网整理了2022初中化学非金属单质的化学性质知识点,供大家参考。
树图思维导图提供 2022初中化学非金属单质的化学性质知识点 在线思维导图免费制作,点击“编辑”按钮,可对 2022初中化学非金属单质的化学性质知识点 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:d6793c31946c7f883e9dec3116d80640
思维导图大纲
2022初中化学非金属单质的化学性质知识点思维导图模板大纲
1、化学惰性:稀有气体;
强氧化性:F2、Cl2、Br2、O2;
以还原性为主:H2、C、Si、B、P、As。
2、典型的非金属较易跟金属化合,一般形成离子键,非金属元素得电子,呈负价。
3、典型的非金属能跟氢气以极性共价键化合生成气态氢化物(ⅣA—ⅦA),共用电子对偏向非金属元素,非金属元素显负价。
4、不同非金属间通过极性键形成化合物,共用电子对偏向吸电子能力强的非金属。
5、非金属氧化物一般为酸性氧化物,其对应的水化物是酸,最高价氧化物对应的水化物酸性越强,则其元素的非金属性也越强。
具体化学性质是:
(1)与金属反应 绝大多数非金属能与金属直接化合生成盐、氧化物、氮化物和碳化物。反应的难易是:强强易,弱弱难。典型的金属与典型的非金属化合形成离子化合物。
2Na+Cl2=2NaCl
3Fe+2O2→Fe3O4
3Mg+N2→Mg3N2
金属活动顺序表里的金属都能与F2、Cl2反应,除Ag、Pt、Au外都能与Br2、I2反应,除Pt、Au外都能与S反应,以上均生成无氧酸盐。
注意:2Na+S=Na2S,Hg+S=HgS较易。
(2)与非金属反应
①与H2反应生成气态氢化物(以极性键形成气态氢化物,水是液态)。反应的难易是:强易弱难,强稳定。即使在温度 H2+Cl2→2HCl 非金属气态氢化物大多具有还原性,其规律是:强者弱。
②与O2反应生成非金属氧化物,除NO、CO外,皆为成盐氧化物。反应规律是强难弱易,卤素不与氧气直接化合,具有强还原性的非金属与氧气反应容易。大多数非金属氧化物是酸性氧化物,其最高氧化物中除CO2为气体外,其余皆为固体。S+O2=2SO24P+5O2=2P2O5 非金属单质形成氧化物的由易到难的程度:P、S、C、Si、N、I、Br、Cl。40℃左右白磷燃烧,300℃左右煤(C)着火。C、Si可在空气中烧尽,N2在2000℃左右才和氧气化合。I2、Br2、Cl2不与氧气直接化合。
③与其它非金属反应
2P+3Cl2=2PCl3
2P+5Cl2=2PCl5
Si+2F2=SiF4
C+2S→CS2
(3)与水反应
2F2+2H2O=4HF+O2-(置换)
Cl2+H2O=HCl+HClO(Br2、I2相同)(歧化)
C+H2O(g)→CO+H2(水煤气)
(4)与碱溶液反应
X2+2NaOH(稀)=NaX+NaXO+H2O(注意:F2例外)
3X2+6NaOH(浓)=5NaX+NaXO3+3H2O(注意:F2例外)
3S+6KOH(浓)=2K2S+K2SO3+3H2O
Si+2NaOH+H2O=Na2SiO3+2H2-
P4+3NaOH+3H2O→3NaH2PO2+PH3-
(5)与氧化性酸反应 不太活泼的非金属C、S、P、I2等具有较强还原性,可被硝酸和浓硫酸等强氧化性酸氧化。
C+2H2SO4(浓)→CO2-+2SO2-+2H2O
C+4HNO3(浓)→CO2-+4NO2-+2H2O
S+2H2SO4(浓)→3SO2-+2H2O
S+6HNO3(浓)→H2SO4+6NO2-+2H2O
P+5HNO3(浓)→H3PO4+5NO2-+H2O
3P(白磷)+5HNO3(稀)+2H2O=3H3PO4+5NO-
I2+10HNO3(浓)=2HIO3+10NO2-+4H2O
(6)与氧化物反应
①与金属氧化物反应(具有还原性的非金属与具有氧化性的金属氧化物发生氧化还原反应。)
C+2CuO→CO2↑+2Cu
C+FeO→CO↑+Fe
Si+2FeO→SiO2+2Fe
H2+CuOH2→O↑+Cu
Na2O+O2=Na2O2
②与非金属氧化物反应
C+H2O→CO+H2
2C+SiO2→2CO↑+Si
3C+SiO2→2CO↑+SiC
2F2+2H2O=4HF+O2-
C+CO2→2CO
2SO2+O2=2SO3
2NO+O2=2NO2
(7)与无氧化酸及无氧酸盐反应 按非金属的活动顺序发生置换反应(强代弱)。
2NaBr+Cl2=2NaCl+Br2
Br2+2NaI=2NaBr+I2
Cl2+Na2S=2NaCl+S
2H2S+O2=2H2O+2S
2H2S+3O2→2H2O+2SO2
相关思维导图模板


树图思维导图提供 904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查 在线思维导图免费制作,点击“编辑”按钮,可对 904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:10b9a8a2dd2fb4593f8130ef16c320fc
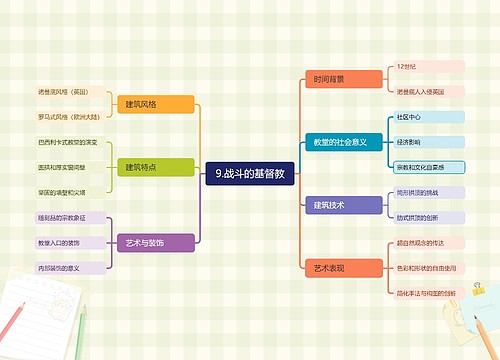

树图思维导图提供 9.战斗的基督教 在线思维导图免费制作,点击“编辑”按钮,可对 9.战斗的基督教 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:33d168acd0cd9f767f809c7a5df86e3a









 上海工商
上海工商