键的极性和分子的极性思维导图

介绍键的极性和分子的极性
树图思维导图提供 键的极性和分子的极性 在线思维导图免费制作,点击“编辑”按钮,可对 键的极性和分子的极性 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:4beb5041677d725a13b7d2164e44f158
思维导图大纲
键的极性和分子的极性思维导图模板大纲
①极性键和非极性键
不同元素原子间形成的共价键——极性键;相同元素原子间形成的共价键——非极性键。
分类依据:共用电子对是否偏移;发生偏移为极性键,不发生偏移为非极性键。
极性大小比较:元素的电负性(元素非金属性)差值越大,共用电子对偏移越多,极性越大。
【说明】在极性键中,非金属性强的元素原子吸引共用电子对的能力强,共用电子对偏向于该原子,该原子带部分负电荷,化合价表现为负价;共用电子对偏离的一方带部分正电荷。
②分子的极性
非极性分子:正负电荷中心重合的分子称为非极性分子。例如:X2
型双原子分子(如H2、Cl2、Br2等)、XYn型多原子分子中键的极性互相抵消的分子(如CO2、CCl4等)都属非极性分子。
极性分子:正负电荷中心不重合的分子称为极性分子。例如XY型双原子分子(如HF、HCl、CO、NO等)、XYn型多原子分子中键的极性不能互相抵消的分子(如SO2、H2O、NH3等)都属极性分子。
分子极性的判断方法:看分子的正电中心和负电中心是否重合或看分子的空间构型是否中心对称。
【说明】极性键与极性分子、非极性键与非极性分子不存在对应关系。判断分子极性时注意常见分子的空间构型、键的极性能否抵消。
③分子极性的应用
相似相溶原理:非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。
相关思维导图模板


树图思维导图提供 904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查 在线思维导图免费制作,点击“编辑”按钮,可对 904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:10b9a8a2dd2fb4593f8130ef16c320fc
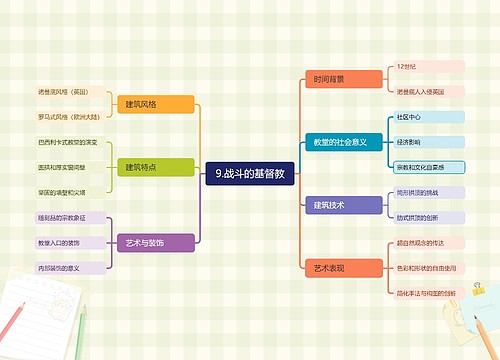

树图思维导图提供 9.战斗的基督教 在线思维导图免费制作,点击“编辑”按钮,可对 9.战斗的基督教 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:33d168acd0cd9f767f809c7a5df86e3a









 上海工商
上海工商