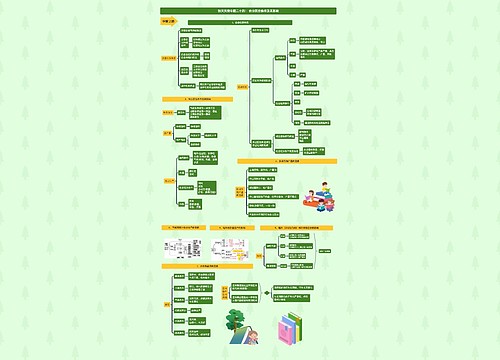
热力学三大定律内容 如何解读热力学三个定律思维导图

有很多的同学是非常想知道,热力学三大定律内容是什么,如何解读热力学三个定律,小编整理了相关信息,希望会对大家有所帮助!
树图思维导图提供 热力学三大定律内容 如何解读热力学三个定律 在线思维导图免费制作,点击“编辑”按钮,可对 热力学三大定律内容 如何解读热力学三个定律 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:9141e8bd4c71dc19177bd8f7090145fe
思维导图大纲
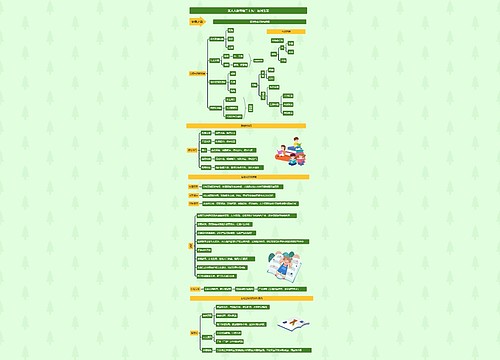
热力学三大定律内容 如何解读热力学三个定律思维导图模板大纲
热力学三大定律的内容有哪些
通常表述为绝对零度时,所有纯物质的完美晶体的熵值为零。是否存在降低温度的极限?1702年,法国物理学家阿蒙顿已经提到了“绝对零度”的概念。他从空气受热时体积和压强都随温度的增加而增加设想在某个温度下空气的压力将等于零。根据他的计算,这个温度即后来提出的摄氏温标约为-239°C,后来,兰伯特更精确地重复了阿蒙顿实验,计算出这个温度为-270.3°C。他说,在这个“绝对的冷”的情况下,空气将紧密地挤在一起。他们的这个看法没有得到人们的重视。直到盖-吕萨克定律提出之后,存在绝对零度的思想才得到物理学界的普遍承认。1848年,英国物理学家汤姆逊在确立热力温标时,重新提出了绝对零度是温度的下限的。1906年,德国物理学家能斯特在研究低温条件下物质的变化时,把热力学的原理应用到低温现象和化学反应过程中,发现了一个新的规律,这个规律被表述为:“当绝对温度赵于零时,凝聚系(固体和液体)的熵(即热量被温度除的商)在等温过程中的改变趋于零。”德国著名物理学家普朗克把这一定律改述为:“当绝对温度趋于零时,固体和液体的熵也趋于零。”这就消除了熵常数取值的任意性。1912年,能斯特又这一规律表为绝对零度不可能达到原理:“不可能使一个物体冷却到绝对温度的零度。”这就是热力学第三定律。在统计物理学上,热力学第三定律反映了微观运动的量子化。在实际意义上,第三定律并不像第一、二定律那样明白地告诫人们放弃制造第一种永动机和第二种永动机的个图。而是鼓励人们想方高法尽可能接近绝对零度。目前使用绝热去磁的方法已达到10 6K,但永远达不到0K。
怎么解读热力学
第一定律:能量守恒定律
由爱因斯坦狭义相对论中所述mass-energy equivalence。能否理解为在一个孤立系统中,能量增加等价于质量增加,能量减少等价于质量减少。质量是能量的另一种表示方法。那么第一定律为何不从相对论的角度做适量的修改。
第二定律:自发反应熵增原理
既然孤立系统小范围自发熵减反应已经被观察到。那么如何修正第二定律的适用范围?
第三定律:完美纯物质晶体在绝对零度熵为零。此处提到晶体是否意味着第三定律的物质状态为固态。是否意味着爱因斯坦-玻色凝聚态(气态)熵不为零。
所有热力学定律的公式
理想气体定律:pV=nRT,以下V为摩尔体积,也就是V/n
热容之间关系:Cp=Cv+R,γ(比热比容)=Cp/Cv
热力学第一定律:dU=dq+dw,w为外力对系统做功,
∵w=-∫fdl=-∫pSdl=-∫pdV
∴dU=dq-pdV
∵q是关于T的函数,所以U可表示为T、V的函数
∴dU=CvdT+CtdV,对于理想气体而言,Ct为零,对于真实气体而言,Ct很小
∴dU=CvdT恒成立
dU=0,pdV=dq
△q=∫(过程1到2)pdV=∫(过程1到2,默认后面都是)RTdV/V=RT*ln(V2/V1)=RT*ln(p1/p2)
dV=0,即dw=0
dU=dq=CvdT,然后积分
dp=0
dq=dU+pdV=CvdT+d(pV)=CvdT+RdT=CpdT
(可直接理解为压强不变时,温度直接决定输入的热能)
dq=0
dU=dw=-pdV=CvdT
∴-RTdV/V=CvdT
∴-RdV/V=CvdT/T
∴-R∫dV/V=Cv∫dT/T
∴R*ln(V1/V2)=Cv*ln(T2/T1)
∴(V1/V2)^R=(T2/T1)^Cv
(V1/V2)^(γ-1)=T2/T1,就得到了体积变化与温度变化的关系
∵T=pV/R
∴代入得(V1/V2)^γ=p2/p1,即p1*V1^γ=p2*V2^γ,pV^γ=常量,
就得到变化压强与变化体积的关系
定义新量:H(焓)=U+pV
∵dU=dq-pdV
∴dU+d(pV)=dq+Vdp,dU+d(pV)=d(U+pV)=dH=dq+Vdp
定义新量:dS(熵)=dq/T,△S=∫dq/T
热力学第二定律:自发过程△S>0,可逆过程△S=0
用来判断是否是自发过程
∵△S>0
∴在恒定温度时,比如说非密闭容器的化学反应
dS>dq/T,(恒定温度时,∫dq/T=0)
∴变换得dq-TdS
相关思维导图模板

树图思维导图提供 一、研究内容 在线思维导图免费制作,点击“编辑”按钮,可对 一、研究内容 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:4f21797dd3e8b08f1951dfc24e7be94f


树图思维导图提供 904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查 在线思维导图免费制作,点击“编辑”按钮,可对 904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:10b9a8a2dd2fb4593f8130ef16c320fc










 上海工商
上海工商