《药品上市许可持有人制度试点方案》政策解读(二)思维导图

一、试点药品范围是否包括原料药? 试点药品范围包括相应类别或者情形的原料药。 二、试点药品范围是否需要同时满足? 不需要,药品品种满足“试点药品范围”中的一项即可申请参加试点。
树图思维导图提供 《药品上市许可持有人制度试点方案》政策解读(二) 在线思维导图免费制作,点击“编辑”按钮,可对 《药品上市许可持有人制度试点方案》政策解读(二) 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:5365d5195e4d81bd7c8f8e7de93b78d9
思维导图大纲
《药品上市许可持有人制度试点方案》政策解读(二)思维导图模板大纲
一、试点药品范围是否包括原料药?
试点药品范围包括相应类别或者情形的原料药。
二、试点药品范围是否需要同时满足?
不需要,药品品种满足“试点药品范围”中的一项即可申请参加试点。
三、治疗用生物制品2类单克隆抗体是否可以申请参加试点?
如拟申报的药品为新药,可考虑按照治疗用生物制品第1类、第7类研发申报;如拟申报的药品为国内已有上市品种,可考虑按照生物类似药研发申报。
四、申请人能否在不同试点省(直辖市)针对不同药品品种分别提交注册申请?
试点工作对申请人(持有人)实行属地管理,试点工作期间申请人只能选择一个试点省份提交申请。
五、在中国境内设立的外资研发机构能否成为申请人?
在试点行政区域内依法设立且能够独立承担责任的药品研发机构可以成为申请人。
六、持有《外国人永久居留证》并在中国境内工作的外籍科研人员能否成为申请人?
不可以。
七、申请人(持有人)可否为多个主体(即联合申报)?
试点工作期间,上市许可申请人及持有人原则上仅为一个主体。
八、《试点方案》中“试点行政区域内的药品生产企业参照本方案中持有人的有关规定执行”如何理解?药品生产企业是否可以申请参加试点工作?
试点行政区域内的药品生产企业可以申请参加试点工作。
九、药品生产企业作为持有人的,是否需要具备与所持有品种相应的生产许可范围?
不需要。如自行生产的,需要具备相应资质。
十、试点工作对于受托生产企业的《药品生产质量管理规范》认证证书具体如何要求?
对于原料药、生物制品,在申报时,相关受托生产企业应当在符合《药品生产质量管理规范》(以下简称GMP)的车间制备,制备过程应当严格执行GMP的要求;上市许可申请获得批准后,相关受托生产企业可以凭试点品种的批准证明文件申请开展GMP认证;通过认证后,方可生产、销售相关产品;委托关系取消,且委托生产品种相对应的药品GMP证书或生产范围是与品种唯一相关的,由受托生产企业所在地省级药品监督管理部门将品种相应的GMP证书或生产范围予以收回或核减。
对于除原料药、生物制品以外的试点药品品种,在申报时,相关受托生产企业应当持有包含相应剂型范围的GMP认证证书。
十一、持有人是否可以委托多个受托生产企业同时生产试点药品?
可以,但持有人应当提交相关技术验证资料,以保证不同产地药品质量和疗效的一致性。
十二、申请人(持有人)是否可以委托第三方主体开展药品质量监管工作?
可以,但相关委托不免除申请人(持有人)应当履行的义务与责任。
十三、试点方案实施前已批准上市的部分药品中,对于通过质量和疗效一致性评价的药品,申请人如何申请参加试点?
对于通过质量和疗效一致性评价的药品,符合试点工作要求的,其药品生产企业可以按照《试点方案》规定的程序申请成为持有人。
十四、已获得《药物临床试验批件》的品种,属于试点药品范围的,能否申请变更(增加)临床试验批件申请人?
符合试点工作要求的,可以申请,并同时提交相关主体签署的解约协议或者合作合同。鉴于目前化学仿制药生物等效性试验(BE试验)已实行备案管理制,故原化学药品注册分类第3类和第6类的相应临床试验批件不再进行相关变更的审批医|学教育网搜集整理。
十五、试点工作的审批主体是省级药品监督管理部门还是食品药品监管总局?
申请人所在地省级药品监督管理部门开展受理工作并提出审核意见后,报食品药品监管总局审评审批。
十六、关联申报的原料药及制剂申请,申请人拟申请参加试点的,是否需要同时提出申请?
不需要。申请人可以选择单独提出原料药或者制剂参加试点工作的申请。
十七、持有人为药品生产企业的,可否在自行生产的同时,申请委托受托生产企业生产试点药品品种?
可以,但持有人应当提交相关技术验证资料,以保证不同产地药品质量和疗效的一致性。
·《药品上市许可持有人制度试点方案》政策解读(一)
·《药品上市许可持有人制度试点方案》政策解读(三)
相关思维导图模板
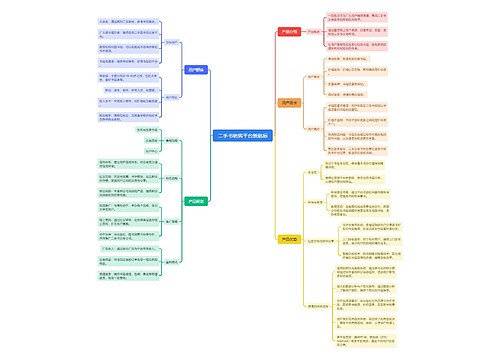

树图思维导图提供 二手书销售平台新航标 在线思维导图免费制作,点击“编辑”按钮,可对 二手书销售平台新航标 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:a92403b70afada50cf4fa4f56e0981c9
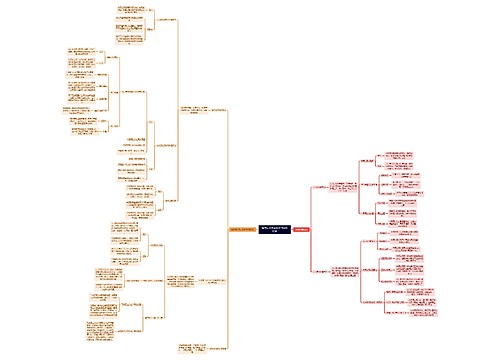

树图思维导图提供 如何从大历史观学习中国历史 在线思维导图免费制作,点击“编辑”按钮,可对 如何从大历史观学习中国历史 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:5a22832470b2860422e8670dd763724d















 上海工商
上海工商