药事管理法规-新药申请的基本要求条例思维导图

树图思维导图为了帮助即将参加执业药师考试的考生顺利复习,搜集整理了相关知识供大家参考,希望可以帮助参加执业药师考试的考生顺利通过考试! 新药申请的基本要求条例: 第十条 药品注册申请人(以下简称申请人),是指提出药品注册申请并承担相应法律责任的机构。
树图思维导图提供 药事管理法规-新药申请的基本要求条例 在线思维导图免费制作,点击“编辑”按钮,可对 药事管理法规-新药申请的基本要求条例 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:0d8e4d7031d2ce6c856c53a586204050
思维导图大纲
药事管理法规-新药申请的基本要求条例思维导图模板大纲
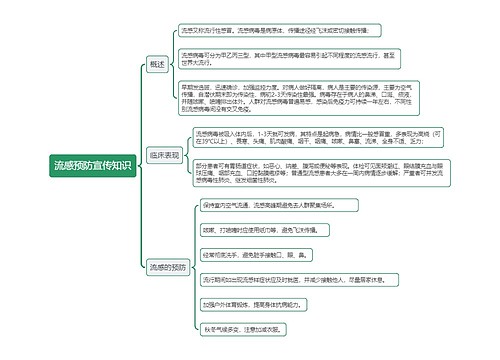
新药申请的基本要求条例:
第十条 药品注册申请人(以下简称申请人),是指提出药品注册申请并承担相应法律责任的机构。
境内申请人应当是在中国境内合法登记并能独立承担民事责任的机构,境外申请人应当是境外合法制药厂商。境外申请人办理进口药品注册,应当由其驻中国境内的办事机构或者由其委托的中国境内代理机构办理。
办理药品注册申请事务的人员应当具有相应的专业知识,熟悉药品注册的法律、法规及技术要求。
第十一条 药品注册申请包括新药申请、仿制药申请、进口药品申请及其补充申请和再注册申请。
境内申请人申请药品注册按照新药申请、仿制药申请的程序和要求办理,境外申请人申请进口药品注册按照进口药品申请的程序和要求办理。
第十二条 新药申请,是指未曾在中国境内上市销售的药品的注册申请。
对已上市药品改变剂型、改变给药途径、增加新适应症的药品注册按照新药申请的程序申报。
仿制药申请,是指生产国家食品药品监督管理局已批准上市的已有国家标准的药品的注册申请;但是生物制品按照新药申请的程序申报。
补充申请,是指新药申请、仿制药申请或者进口药品申请经批准后,改变、增加或者取消原批准事项或者内容的注册申请。
再注册申请,是指药品批准证明文件有效期满后申请人拟继续生产或者进口该药品的注册申请。
相关思维导图模板

树图思维导图提供 数智技术在工程设备管理中的应用 在线思维导图免费制作,点击“编辑”按钮,可对 数智技术在工程设备管理中的应用 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:f9a2de84ad9a9ceebc96385d71be9ebe

树图思维导图提供 数据治理规定 在线思维导图免费制作,点击“编辑”按钮,可对 数据治理规定 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:2d62d3c46748939c7f599c53001b9d40





 上海工商
上海工商