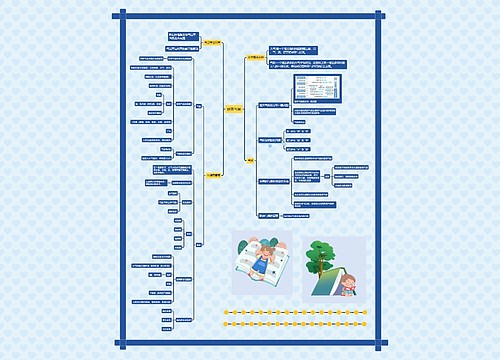
新药的临床试验思维导图

新药的临床试验: 第五十条 申请人完成临床前研究后,应当填写《药品注册申请表》,向所在地省、自治区、直辖市药品监督管理部门如实报送有关资料。
树图思维导图提供 新药的临床试验 在线思维导图免费制作,点击“编辑”按钮,可对 新药的临床试验 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:e4bd4aa48a6db23dc31d65dd71ede19f
思维导图大纲
新药的临床试验思维导图模板大纲
新药的临床试验:
第五十条 申请人完成临床前研究后,应当填写《药品注册申请表》,向所在地省、自治区、直辖市药品监督管理部门如实报送有关资料。
第五十一条 省、自治区、直辖市药品监督管理部门应当对申报资料进行形式审查,符合要求的,出具药品注册申请受理通知书;不符合要求的,出具药品注册申请不予受理通知书,并说明理由。
第五十二条 省、自治区、直辖市药品监督管理部门应当自受理申请之日起5日内组织对药物研制情况及原始资料进行现场核查,对申报资料进行初步审查,提出审查意见。申请注册的药品属于生物制品的,还需抽取3个生产批号的检验用样品,并向药品检验所发出注册检验通知。
第五十三条 省、自治区、直辖市药品监督管理部门应当在规定的时限内将审查意见、核查报告以及申报资料送交国家食品药品监督管理局药品审评中心,并通知申请人。
第五十四条 接到注册检验通知的药品检验所应当按申请人申报的药品标准对样品进行检验,对申报的药品标准进行复核,并在规定的时间内将药品注册检验报告送交国家食品药品监督管理局药品审评中心,并抄送申请人。
第五十五条 国家食品药品监督管理局药品审评中心收到申报资料后,应在规定的时间内组织药学、医学及其他技术人员对申报资料进行技术审评,必要时可以要求申请人补充资料,并说明理由。完成技术审评后,提出技术审评意见,连同有关资料报送国家食品药品监督管理局。
国家食品药品监督管理局依据技术审评意见作出审批决定。符合规定的,发给《药物临床试验批件》;不符合规定的,发给《审批意见通知件》,并说明理由。
相关思维导图模板

树图思维导图提供 二手书销售平台新航标 在线思维导图免费制作,点击“编辑”按钮,可对 二手书销售平台新航标 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:a92403b70afada50cf4fa4f56e0981c9


树图思维导图提供 (一)诸子百家学说——儒学产生的土壤(23分钟) 在线思维导图免费制作,点击“编辑”按钮,可对 (一)诸子百家学说——儒学产生的土壤(23分钟) 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:61d7b901b01e24c661b919301dc1d26a








 上海工商
上海工商