新药监测期概述思维导图

新药监测期概述: 第六十六条 国家食品药品监督管理局根据保护公众健康的要求,可以对批准生产的新药品种设立监测期。监测期自新药批准生产之日起计算,最长不得超过5年。 监测期内的新药,国家食品药品监督管理局不批准其他企业生产、改变剂型和进口。
树图思维导图提供 新药监测期概述 在线思维导图免费制作,点击“编辑”按钮,可对 新药监测期概述 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:98cacf314292ca9f7b1ca0b220499560
思维导图大纲
新药监测期概述思维导图模板大纲
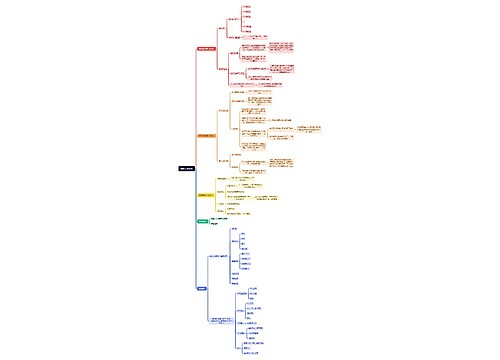
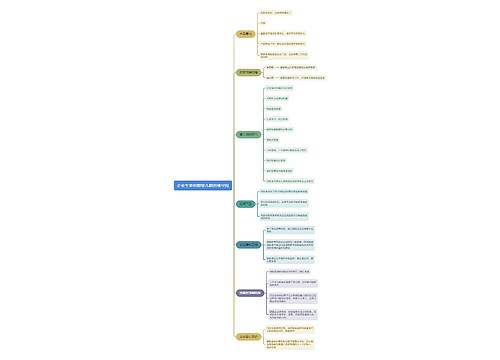
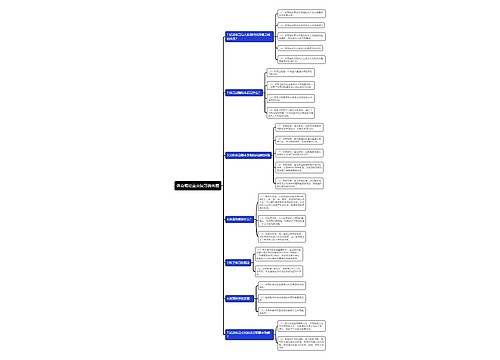
新药监测期概述:
第六十六条 国家食品药品监督管理局根据保护公众健康的要求,可以对批准生产的新药品种设立监测期。监测期自新药批准生产之日起计算,最长不得超过5年。
监测期内的新药,国家食品药品监督管理局不批准其他企业生产、改变剂型和进口。
第六十七条 药品生产企业应当考察处于监测期内的新药的生产工艺、质量、稳定性、疗效及不良反应等情况,并每年向所在地省、自治区、直辖市药品监督管理部门报告。药品生产企业未履行监测期责任的,省、自治区、直辖市药品监督管理部门应当责令其改正。
第六十八条 药品生产、经营、使用及检验、监督单位发现新药存在严重质量问题、严重或者非预期的不良反应时,应当及时向省、自治区、直辖市药品监督管理部门报告。省、自治区、直辖市药品监督管理部门收到报告后应当立即组织调查,并报告国家食品药品监督管理局。
第六十九条 药品生产企业对设立监测期的新药从获准生产之日起2年内未组织生产的,国家食品药品监督管理局可以批准其他药品生产企业提出的生产该新药的申请,并重新对该新药进行监测。
第七十条 新药进入监测期之日起,国家食品药品监督管理局已经批准其他申请人进行药物临床试验的,可以按照药品注册申报与审批程序继续办理该申请,符合规定的,国家食品药品监督管理局批准该新药的生产或者进口,并对境内药品生产企业生产的该新药一并进行监测。
第七十一条 新药进入监测期之日起,不再受理其他申请人的同品种注册申请。已经受理但尚未批准进行药物临床试验的其他申请人同品种申请予以退回;新药监测期满后,申请人可以提出仿制药申请或者进口药品申请。
第七十二条 进口药品注册申请首先获得批准后,已经批准境内申请人进行临床试验的,可以按照药品注册申报与审批程序继续办理其申请,符合规定的,国家食品药品监督管理局批准其进行生产;申请人也可以撤回该项申请,重新提出仿制药申请。对已经受理但尚未批准进行药物临床试验的其他同品种申请予以退回,申请人可以提出仿制药申请。








 上海工商
上海工商