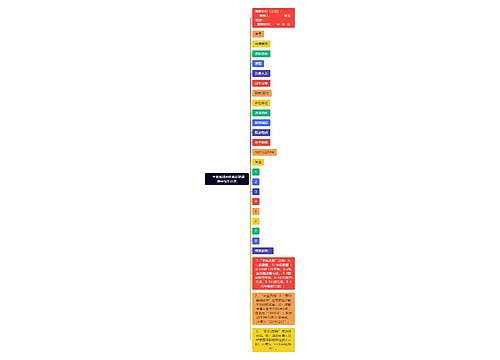
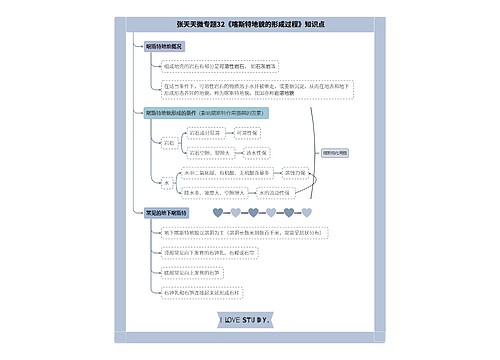
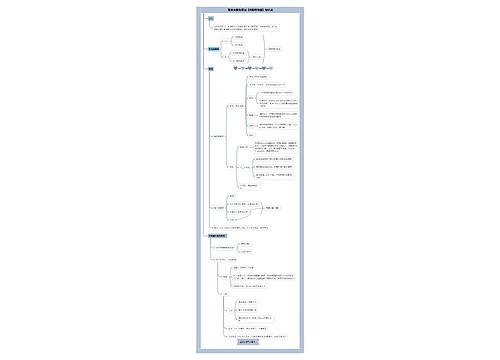
新药申请基本要求条例思维导图

新药申请基本要求条例: 第十条 药品注册申请人(以下简称申请人),是指提出药品注册申请并承担相应法律责任的机构。 境内申请人应当是在中国境内合法登记并能独立承担民事责任的机构,境外申请人应当是境外合法制药厂商。境外申请人办理进口药品注册,应当由其驻中国境内的办事机构或者由其委托的中国境内代理机构办理。
树图思维导图提供 新药申请基本要求条例 在线思维导图免费制作,点击“编辑”按钮,可对 新药申请基本要求条例 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:a3f859474411eac8fcaccca914552cfd
思维导图大纲
新药申请基本要求条例思维导图模板大纲
新药申请基本要求条例:
第十条 药品注册申请人(以下简称申请人),是指提出药品注册申请并承担相应法律责任的机构。
境内申请人应当是在中国境内合法登记并能独立承担民事责任的机构,境外申请人应当是境外合法制药厂商。境外申请人办理进口药品注册,应当由其驻中国境内的办事机构或者由其委托的中国境内代理机构办理。
办理药品注册申请事务的人员应当具有相应的专业知识,熟悉药品注册的法律、法规及技术要求。
第十一条 药品注册申请包括新药申请、仿制药申请、进口药品申请及其补充申请和再注册申请。
境内申请人申请药品注册按照新药申请、仿制药申请的程序和要求办理,境外申请人申请进口药品注册按照进口药品申请的程序和要求办理。
第十二条 新药申请,是指未曾在中国境内上市销售的药品的注册申请。
对已上市药品改变剂型、改变给药途径、增加新适应症的药品注册按照新药申请的程序申报。
仿制药申请,是指生产国家食品药品监督管理局已批准上市的已有国家标准的药品的注册申请;但是生物制品按照新药申请的程序申报。
补充申请,是指新药申请、仿制药申请或者进口药品申请经批准后,改变、增加或者取消原批准事项或者内容的注册申请。
再注册申请,是指药品批准证明文件有效期满后申请人拟继续生产或者进口该药品的注册申请。
相关思维导图模板

树图思维导图提供 年度成都市教育科研课题申报汇总表 在线思维导图免费制作,点击“编辑”按钮,可对 年度成都市教育科研课题申报汇总表 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:b5c0f483314a011ec021b42639180f07
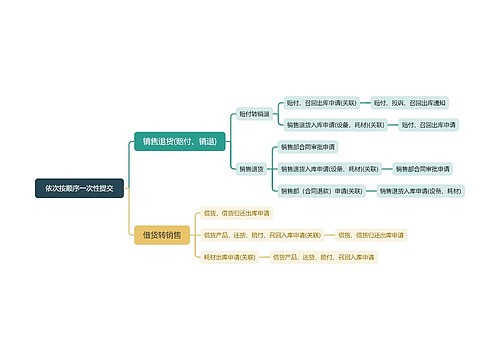

树图思维导图提供 依次按顺序一次性提交 在线思维导图免费制作,点击“编辑”按钮,可对 依次按顺序一次性提交 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:c758d1ca3e0c077ce4a393a2348a41b5










 上海工商
上海工商