药品注册现场核查管理制度思维导图

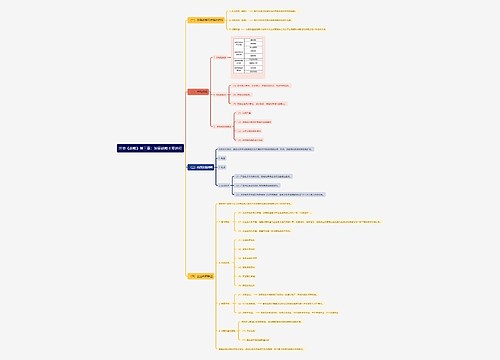
第一条为加强药品注册现场核查管理,规范药品研制秩序,根据《中华人民共和国药品管理法》及其实施条例、《药品注册管理办法》,制定本规定。 第二条药品注册现场核查分为研制现场核查和生产现场检查。
树图思维导图提供 药品注册现场核查管理制度 在线思维导图免费制作,点击“编辑”按钮,可对 药品注册现场核查管理制度 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:5f9eac4c38bb9c11ad8bd16881c19355
思维导图大纲
药品注册现场核查管理制度思维导图模板大纲
第一条为加强药品注册现场核查管理,规范药品研制秩序,根据《中华人民共和国药品管理法》及其实施条例、《药品注册管理办法》,制定本规定。
第二条药品注册现场核查分为研制现场核查和生产现场检查。
药品注册研制现场核查,是指药品监督管理部门对所受理药品注册申请的研制情况进行实地确证,对原始记录进行审查,确认申报资料真实性、准确性和完整性的过程。
药品注册生产现场检查,是指药品监督管理部门对所受理药品注册申请批准上市前的样品批量生产过程等进行实地检查,确认其是否与核定的或申报的生产工艺相符合的过程。
本规定所指的药品注册检验抽样,是指药品监督管理部门在药品注册现场核查过程中进行的取样、封样和通知检验。
第三条药品注册现场核查分为常规和有因。有因核查主要是指针对下列情形进行的现场核查:(一)药品审评过程中发现的问题;(二)药品注册相关的举报问题;(三)药品监督管理部门认为需进行核查的其他情形。
第五条省、自治区、直辖市药品监督管理部门负责本行政区域内的下列药品注册现场核查:(一)负责所受理药品注册申请的研制现场核查;(二)负责所受理已上市药品改变剂型、改变给药途径注册申请的生产现场检查;(三)负责所受理仿制药注册申请的生产现场检查;(四)负责所受理药品生产技术转让、变更处方和生产工艺可能影响产品质量等补充申请的生产现场检查;(五)负责本行政区域内的有因核查。
研制工作跨省进行的药品注册申请,研制现场核查工作由受理该申请的省、自治区、直辖市药品监督管理部门负责,研制现场所在地省、自治区、直辖市药品监督管理部门应当予以协助。
相关思维导图模板


树图思维导图提供 异业联盟管理制度 在线思维导图免费制作,点击“编辑”按钮,可对 异业联盟管理制度 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:b6fe7031e9d5adcfdbaecf3055cf0f36

树图思维导图提供 SPD医用耗材库房上墙管理制度大纲 在线思维导图免费制作,点击“编辑”按钮,可对 SPD医用耗材库房上墙管理制度大纲 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:38d26c7d87d762d36f060be70a9eb1b2








 上海工商
上海工商