药品电子监管工作操作规范思维导图

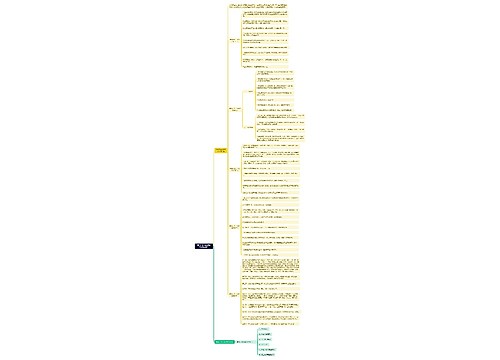
一、入网操作规范 (一)监管部门入网流程 1.登录中国药品电子监管网,点击首页"监管用户入网",下载《中国药品电子监管网入网手册-监管用户分册》; 2.在资料下载区下载《监管用户入网登记表》,填写完备后,将电子版发送至邮箱cdea@sfda.gov.cn(请在邮件主题中填写"××食品药品监督管理局入网登记表"),并加盖公章传真至
树图思维导图提供 药品电子监管工作操作规范 在线思维导图免费制作,点击“编辑”按钮,可对 药品电子监管工作操作规范 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:6db36ec2e0a3c7ea6db7bb482d71ac1a
思维导图大纲
药品电子监管工作操作规范思维导图模板大纲
一、入网操作规范
(一)监管部门入网流程
1.登录中国药品电子监管网,点击首页"监管用户入网",下载《中国药品电子监管网入网手册-监管用户分册》;
2.在资料下载区下载《监管用户入网登记表》,填写完备后,将电子版发送至邮箱cdea@sfda.gov.cn(请在邮件主题中填写"××食品药品监督管理局入网登记表"),并加盖公章传真至:010-51342277;
3.将申请表原件附数字证书操作员身份证复印件由省级药品监督管理部门(以下简称省局)汇总邮寄至中国药品电子监管网客户服务中心;
4.缴纳数字证书费用(费用相关问题请咨询中国药品电子监管网客户服务中心,咨询电话:95001111)后,中国药品电子监管网负责制作并派发。
(二)企业入网流程
1.企业登录电子监管网填写入网登记表,并将相关材料邮寄至所在地的省局,并向电子监管网缴纳数字证书服务费;
2.各级药品监督管理部门负责在电子监管网政府端,对所辖范围内申请加入电子监管网的企业进行审核;
3.中国药品电子监管网客户服务中心为审核通过并已缴纳数字证书服务费的企业制作数字证书;
4.中国药品电子监管网客户服务中心完成数字证书制作后,邮寄至申请入网的企业翳学教育网整理。
二、数据上传操作规范
(一)生产企业药品关联关系上传流程
1.药品生产企业在生产线上为赋码药品建立各级包装关联关系;
2.药品下线后生产企业通过电子监管网客户端完成关联关系的上报工作。生产企业完成关联关系信息上报工作后,新生产的药品方可入库。
(二)药品核注核销上传流程
1.药品到货入库时,企业应立即采集到货药品包装上的药品电子监管码;入库信息采集完成后,企业应立即通过电子监管网客户端完成入库信息上报工作。
2.药品出库时,企业应立即采集出库药品包装上的药品电子监管码;出库信息采集完成后,企业应立即通过电子监管网客户端完成出库信息上报工作翳学教育网整理。
三、信息维护、变更操作规范
(一)药品信息维护流程
1.生产企业登录国家食品药品监督管理局(以下简称国家局)网站,在"数据查询"中核对本企业药品信息,与实际相符即可向电子监管网申请药品信息维护。
2.若在国家局查询不到相关信息或与企业所持"国家食品药品监督管理局药品注册批件"信息存在不一致,需要企业先向国家局进行备案更新,联系电话:010-63923253,传真:010-63923254。
3.生产企业如已查询到国家局信息已备案,可向国家局申请进行药品信息的新增、变更。流程如下:
生产企业登录电子监管网,下载生产企业产品登记表。网站首页http://www.drugadmin.com/>>资料下载>>网站表单下载>>中国药品电子监管网生产企业产品登记表。企业填报时,需选择准确的药品基本类型。
4.生产企业将填写完备的登记表,加盖公章,传真至中国药品电子监管网客户服务中心,传真:010-51342277,并发送电子版到cdea@sfda.gov.cn邮箱。
5.中国药品电子监管网客户服务中心收到生产企业提交的《企业产品登记表》后,负责在电子监管网政府端,对药品信息进行新增或变更。
(二)企业信息变更流程
1.企业通过电子监管网客户端提交企业信息变更申请;
2.各省局负责在电子监管网政府端,对所辖范围内企业的信息变更申请进行审核。
(三)企业证书信息维护流程
1.企业通过电子监管网客户端提交生产、经营许可证或GMP、GSP证书维护申请;
2.各省局负责在电子监管网政府端,对所辖范围内企业的信息维护申请进行审核。
四、预警处理操作规范
(一)药品批准文号已过期预警
处理方法:监管部门核实企业是否违规生产(批准文号已过期)。
情况一:如果企业违规,监管部门应按照相关规定进行处理,处理完毕后在系统中填写处理结果,监管部门手工关闭预警;
情况二:如果是药品批准文号有效期信息未更新导致,由省局负责通过电子监管网政府端功能,修改批准文号有效期,系统自动关闭预警。
药品批准文号有效期变更后,省局应当通过电子监管网政府端功能变更相关信息。
(二)企业证书过期预警
处理方法:监管部门核实企业是否违规生产、经营(企业证书过期)。
情况一:如果企业违规,监管部门应按照相关规定进行处理,处理完毕后在系统中填写处理结果,监管部门手工关闭预警;
情况二:如果企业已经更换了新的证书,因证书信息未更新导致,由省局通过电子监管网政府端功能,修改药品批准文号或证书有效期,系统自动关闭预警。
(三)超计划生产预警
处理方法:监管部门核实企业是否违规生产特殊药品(超过国家批准的年度生产量)。
情况一:如果企业违规生产特殊药品,监管部门应按照相关规定进行处理,处理完毕后在系统中填写处理结果,手工关闭预警;
情况二:如果是特殊药品年度生产收购计划维护错误或者未及时维护追加计划,应当及时与国家局药品安全监管司特殊药品监管处取得联系,并及时通过电子监管网政府端更新计划,计划更新后,监管部门通过电子监管网政府端手工关闭预警。
(四)超计划购买预警
处理方法:监管部门核实企业是否违规购买特殊药品(超过国家批准的年度收购量)。
情况一:如果企业违规购买特殊药品,监管部门应按照相关规定进行处理,处理完毕后在系统中填写处理结果,手工关闭预警;
情况二:如果是特殊药品年度生产收购计划维护错误或者未及时维护追加计划,应当及时与国家局药品安全监管司特殊药品监管处取得联系,通过电子监管网政府端更新计划,计划更新后,监管部门通过电子监管网政府端手工关闭预警翳学教育网整理。
(五)库存报损报溢预警
处理方法:监管部门核实企业是否有违规经营药品的情况。
情况一:如果企业违规经营药品,监管部门应按照相关规定进行处理,处理完毕后在系统中填写处理结果,监管部门手工关闭预警;
情况二:如果企业是正常经营药品,监管部门可通过电子监管网政府端,填写处理结果手工关闭预警。
(六)未勾兑预警
处理方法:企业对预警信息进行核实。
情况一:未报入(出)库单据的企业补报入(出)库单据,补报入(出)库单据无误后,系统自动关闭预警;
情况二:无法补报入(出)库单据的,省局应当在事件处理完成后,通过电子监管网政府端填写处理结果并手工关闭预警。
(七)勾兑不符预警
处理方法:企业对预警信息进行核实。
情况一:企业错报数据应通过上传新单据进行修正,系统根据上传的新单据解析成功后自动关闭预警;
情况二:无法修正入(出)库单据的,省局应当在事件处理完成后,通过电子监管网政府端填写处理结果并手工关闭预警。
(八)药品已过期预警
处理方法:企业对预警信息进行核实翳学教育网整理。
情况一:如果是生产企业对错报有效期数据,要求其进行修正,处理完毕后在系统中填写处理结果,监管部门手工关闭预警;
情况二:如果企业违规经营药品,监管部门应按照相关规定进行处理,处理完毕后在系统中填写处理结果,监管部门手工关闭预警。









 上海工商
上海工商