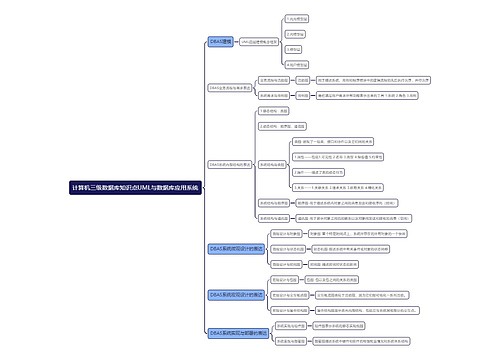
药物临床试验期间安全性数据快速报告标准和程序思维导图

各种不良反应与问题报告全内容详解
树图思维导图提供 药物临床试验期间安全性数据快速报告标准和程序 在线思维导图免费制作,点击“编辑”按钮,可对 药物临床试验期间安全性数据快速报告标准和程序 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:218b133a2b486d4c28b5aeb18c076998
思维导图大纲
药物临床试验期间安全性数据快速报告标准和程序思维导图模板大纲
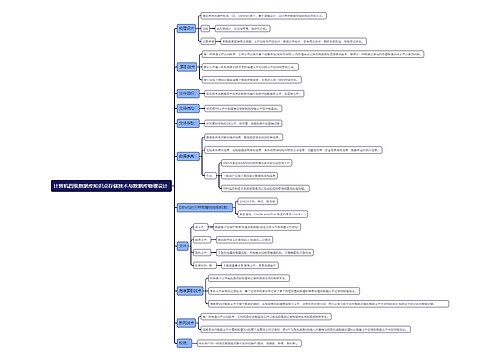
执行范围
临床试验期间发生的(包括中国境内和境外)所有与试验药物肯定相关或可疑的SUSAR
获得审批审批结论前发生的SUSAR
严重不良反应情形
导致死亡
危及生命
导致住院和住院时间延长
永久或显著的功能丧失
致畸、致出生缺陷
其他重要医学事件
非预期不良反应定义
不良反应的性质、严重程度、后果或频率,不同于试验药物当前相关资料所描述的预期风险
个例安全性快速报告
1、判断与试验药物肯定相关或可疑的非预期严重不良反应
2、申请人和研究者在不良事件和药物因果关系判断不一致
3、任意方不能排除与试验药物相关的
其他报告情形
阳性对照药相关的严重不良事件
其他潜在的严重的安全性风险信息
1、明显影响药品风险获益评估的信息
2、可能考虑药品用法改变
3、影响总体药品研发进程的信息
举例
(1)对于已知的、严重的不良反应发生率增加,判断具有临床重要性
(2)对暴露人群有明显的危害,如在治疗危及生命时疾病药品无效
(3)在新近完成的动物试验中重大安全性发现(如致癌性)
不作为快速报告内容
1、非严重不良事件
2、严重不良事件与试验药物无关
3、严重但属于预期的不良反应
4、当以严重不良事件作为主要疗效终点
5、与安慰剂相关的不良反应
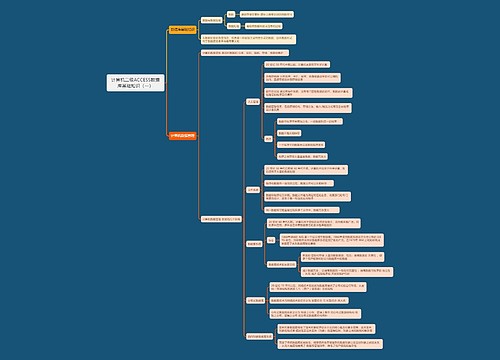
安全信息监测和SUSAR报告责任主体
申请人
1、专职人员负责
2、制定SOP
3、对所有相关人员培训
4、掌握最新安全信息,及时进行风险评估
5、向试验相关方通报相关信息
6、对SUSAR进行快速报告
SAE上报时限
1、首次获知后<7天
致死或危及生命的SUSAR
2、首次获知后<15天
非致死或危及生命的SUSAR
3、获得新信息15天内
随访报告
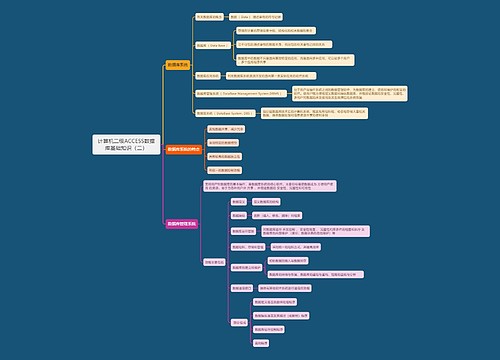
上报思维导图模板大纲
1、ICH《E2B(R3):临床安全数据管理:个例安全性报告传输的数据要素》
2、相关术语采用ICH《M1:监管活动医学词典(MedDRA)》进行编码
3、GATWAY方式提交、XML递交
快速报告时间思维导图模板大纲
开始时间:临床试验批准日期/国家药品审评中心默示许可时间
结束时间:国内最后一例受试者随访结束时间
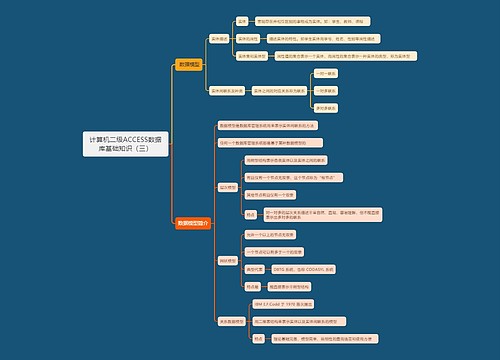
上报思维导图模板大纲
邮件:cqjywjj@cde.org.cn
国家药品审评接收报告思维导图模板大纲
1、符合ICH E2B(R3)的电子传输方式
2、中文(境内、境外)
3、注明药物申请临床试验受理号
相关思维导图模板

树图思维导图提供 904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查 在线思维导图免费制作,点击“编辑”按钮,可对 904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:10b9a8a2dd2fb4593f8130ef16c320fc
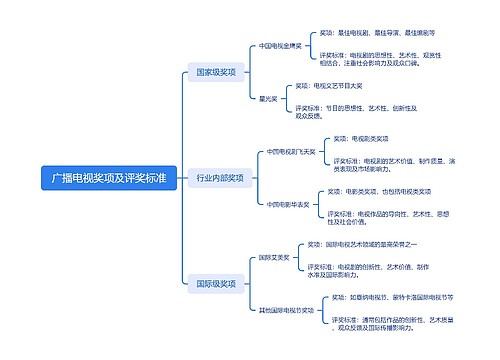

树图思维导图提供 广播电视奖项及评奖标准 在线思维导图免费制作,点击“编辑”按钮,可对 广播电视奖项及评奖标准 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:a4210651fa3a78355ac9f5101bb2c616





 上海工商
上海工商