初三化学上册考点知识点归纳思维导图

化学是初中最重要的学科之一,将化学知识点总结进行一一归纳,能够提高自己的学习效率。
树图思维导图提供 初三化学上册考点知识点归纳 在线思维导图免费制作,点击“编辑”按钮,可对 初三化学上册考点知识点归纳 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:feb442c928c175a5387a734de94d2d3b
思维导图大纲
初三化学上册考点知识点归纳思维导图模板大纲
化学是初中最重要的学科之一,将化学知识点总结进行一一归纳,能够提高自己的学习效率。下面树图网给大家整理了关于初三化学上册考点知识点归纳的内容,欢迎阅读,内容仅供参考!
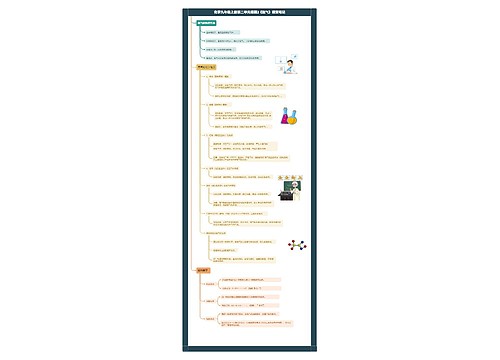
初三化学上册考点知识点归纳
1、我国古代三大化学工艺:造纸,制火药,烧瓷器。
2、氧化反应的三种类型:爆炸,燃烧,缓慢氧化。
3、构成物质的三种微粒:分子,原子,离子。
4、不带电的三种微粒:分子,原子,中子。
5、物质组成与构成的三种说法:
(1)、二氧化碳是由碳元素和氧元素组成的;
(2)、二氧化碳是由二氧化碳分子构成的;
(3)、一个二氧化碳分子是由一个碳原子和一个氧原子构成的。
6、构成原子的三种微粒:质子,中子,电子。
7、造成水污染的三种原因:(1)工业"三废"任意排放,(2)生活污水任意排放
(3)农药化肥任意施放
8、收集方法的三种方法:排水法(不容于水的气体),
向上排空气法(密度比空气大的气体),
向下排空气法(密度比空气小的气体)。
9、质量守恒定律的三个不改变:原子种类不变,原子数目不变,原子质量不变。
10、不饱和溶液变成饱和溶液的三种方法:增加溶质,减少溶剂,改变温度(升高或降低)。
11、复分解反应能否发生的三个条件:生成水、气体或者沉淀
12、三大化学肥料:N、P、K
13、排放到空气中的三种气体污染物:一氧化碳、氮的氧化物,硫的氧化物。
14、燃烧发白光的物质:镁条,木炭,蜡烛(二氧化碳和水)。
15、具有可燃性,还原性的物质:氢气,一氧化碳,单质碳。
16、具有可燃性的三种气体是:氢气(理想),一氧化碳(有毒),甲烷(常用)。
17、CO的三种化学性质:可燃性,还原性,毒性。
18、三大矿物燃料:煤,石油,天然气。(全为混合物)
19、三种黑色金属:铁,锰,铬。
20、铁的三种氧化物:氧化亚铁,三氧化二铁,四氧化三铁。
21、炼铁的三种氧化物:铁矿石,焦炭,石灰石。
22、常见的三种强酸:盐酸,硫酸,硝酸。
23、浓硫酸的三个特性:吸水性,脱水性,强氧化性。
24、氢氧化钠的三个俗称:火碱,烧碱,苛性钠。
25、碱式碳酸铜受热分解生成的三种氧化物:氧化铜,水(氧化氢),二氧化碳。
26、实验室制取CO2不能用的三种物质:硝酸,浓硫酸,碳酸钠。
27、酒精灯的三个火焰:内焰,外焰,焰心。
28、使用酒精灯有三禁:禁止向燃着的灯里添加酒精,禁止用酒精灯去引燃另一只酒精灯,禁止用嘴吹灭酒精灯。
29、玻璃棒在粗盐提纯中的三个作用:搅拌、引流、转移。
30、液体过滤操作中的三靠:(1)倾倒滤液时烧杯口紧靠玻璃棒,(2)玻璃棒轻靠在三层滤纸的一端,(3)漏斗下端管口紧靠烧杯内壁。
31、固体配溶液的三个步骤:计算,称量,溶解。
32、浓配稀的三个步骤:计算,量取,溶解。
33、浓配稀的三个仪器:烧杯,量筒,玻璃棒。
34、三种遇水放热的物质:浓硫酸,氢氧化钠,生石灰。
35、过滤两次滤液仍浑浊的原因:滤纸破损,仪器不干净,液面高于滤纸边缘。
36、药品取用的三不原则:不能用手接触药品,不要把鼻孔凑到容器口闻药品的气味,不得尝任何药品的味道。
37、金属活动顺序的三含义:
(1)金属的位置越靠前,它在水溶液中越容易失去电子变成离子,它的活动性就越强;
(2)排在氢前面的金属能置换出酸里的氢,排在氢后面的金属不能置换出酸里的氢;
(3)排在前面的金属能把排在后面的金属从它们的盐溶液中置换出来。
38、温度对固体溶解度的影响:
(1)大多数固体物质的溶解度随着温度的升高而增大,
(2)少数固体物质的溶解度受温度影响变化不大
(3)极少数固体物质的溶解度随着温度的升高而减小。
39、影响溶解速度的因素:(1)温度,(2)是否搅拌(3)固体颗粒的大小。
40、使铁生锈的三种物质:铁,水,氧气。
41、溶质的三种状态:固态,液态,气态。
42、影响溶解度的三个因素:溶质的性质,溶剂的性质,温度。
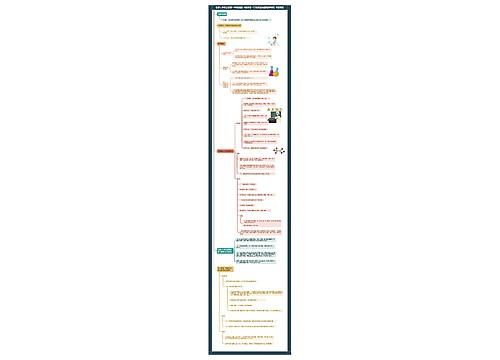
初三化学上册方程式
一、氧气的性质
(1)单质与氧气的反应:(化合反应)
1.镁在空气中燃烧:2Mg + O2 点燃2MgO
2.铁在氧气中燃烧:3Fe + 2O2 点燃Fe3O4
3.铜在空气中受热:2Cu + O2 加热2CuO
4.铝在空气中燃烧:4Al + 3O2 点燃2Al2O3
5.氢气中空气中燃烧:2H2 + O2 点燃2H2O
6.红磷在空气中燃烧(研究空气组成的实验):4P + 5O2 点燃2P2O5
7.硫粉在空气中燃烧:S + O2 点燃SO2
8.碳在氧气中充分燃烧:C + O2 点燃CO2
9.碳在氧气中不充分燃烧:2C + O2 点燃2CO
(2)化合物与氧气的反应:
10.一氧化碳在氧气中燃烧:2CO + O2 点燃2CO2
11.甲烷在空气中燃烧:CH4 + 2O2 点燃CO2 + 2H2O
12.酒精在空气中燃烧:C2H5OH+ 3O2 点燃2CO2+ 3H2O
(3)氧气的来源:
13. 拉瓦锡研究空气的成分实验2HgO 加热Hg+ O2 ↑
14. 加热高锰酸钾:2KMnO4加热K2MnO4+ MnO2 + O2↑(实验室制氧气原理1)
加热氯酸钾:2KClO3加热2KCl + 3O2↑(实验室制氧气原理2)
15.过氧化氢在二氧化锰作催化剂条件下分解反应:
H2O2 MnO22H2O+ O2 ↑(实验室制氧气原理3)
二、自然界中的水
16. 水在直流电的作用下分解(研究水的组成实验):2H2O通电2H2↑+ O2 ↑
17. 生石灰溶于水:CaO + H2O= Ca(OH)2
18. 二氧化碳可溶于水:H2O+ CO2= H2CO3
三、质量守恒定律
19. 镁在空气中燃烧:2Mg+ O2 点燃2MgO
20. 铁和硫酸铜溶液反应:Fe + CuSO4 = FeSO4+ Cu
21. 氢气还原氧化铜:H2+ CuO 加热Cu + H2O
22. 镁还原氧化铜:Mg+ CuO 加热Cu + MgO
四、碳和碳的氧化物
(1)碳的化学性质
23.碳在氧气中充分燃烧:C + O2点燃CO2
24. 木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑
25. 焦炭还原氧化铁:3C+ 2Fe2O3 高温4Fe + 3CO2↑
(2)煤炉中发生的三个反应:(几个化合反应)
26.煤炉的底层:C + O2 点燃CO2
27.煤炉的中层:CO2 + C 高温2CO
28.煤炉的上部蓝色火焰的产生:2CO + O2 点燃2CO2
(3)二氧化碳的制法与性质:
29.大理石与稀盐酸反应(实验室制二氧化碳):
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
30.碳酸不稳定而分解:H2CO3= H2O + CO2↑
31.二氧化碳可溶于水:H2O + CO2=H2CO3
32.高温煅烧石灰石(工业制二氧化碳):CaCO3 高温CaO + CO2↑
33.石灰水与二氧化碳反应(鉴别二氧化碳):
Ca(OH)2 + CO2 = CaCO3 ↓+ H2O
(4)一氧化碳的性质:
34.一氧化碳还原氧化铜:CO+ CuO 加热Cu + CO2
35.一氧化碳的可燃性:2CO + O2 点燃2CO2
其它反应:
36.碳酸钠与稀盐酸反应(灭火器的原理):
Na2CO3 + 2HCl = 2NaCl +H2O + CO2↑
五、燃料及其利用
37.甲烷在空气中燃烧:CH4 + 2O2点燃CO2 + 2H2O
38.酒精在空气中燃烧:C2H5OH + 3O2 点燃2CO2 + 3H2O
39.氢气中空气中燃烧:2H2 + O2 点燃2H2O
40.实验室制取氢气:Zn+H2SO4=ZnSO4+H2↑
初三化学上册推断题解题技巧:
看其颜色,观其状态,察其变化,初代验之,验而得之。
1、常见物质的颜色:多数气体为无色,多数固体化合物为白色,多数溶液为无色。
2、一些特殊物质的颜色:
黑色:MnO2、CuO、Fe3O4、C、FeS(硫化亚铁)
蓝色:CuSO4o5H2O、Cu(OH)2、CuCO3、含Cu2+溶液、
液态固态O2(淡蓝色)
红色:Cu(亮红色)、Fe2O3(红棕色)、红磷(暗红色)
黄色:硫磺(单质S)、含Fe3+的溶液(棕黄色)
绿色:FeSO4o7H2O、含Fe2+的溶液(浅绿色)、碱式碳酸铜[Cu2(OH)2CO3]
无色气体:N2、CO2、CO、O2、H2、CH4
有色气体:Cl2(黄绿色)、NO2(红棕色)
有刺激性气味的气体:NH3(此气体可使湿润pH试纸变蓝色)、SO2
有臭鸡蛋气味:H2S
3、常见一些变化的判断:
①白色沉淀且不溶于稀硝酸或酸的物质有:BaSO4、AgCl(就这两种物质)
②蓝色沉淀:Cu(OH)2、CuCO3
③红褐色沉淀:Fe(OH)3、Fe(OH)2为白色絮状沉淀,但在空气中很快变成灰绿色沉淀,再变成Fe(OH)3红褐色沉淀
④沉淀能溶于酸并且有气体(CO2)放出的:不溶的碳酸盐
⑤沉淀能溶于酸但没气体放出的:不溶的碱
4、酸和对应的酸性氧化物的联系:
①酸性氧化物和酸都可跟碱反应生成盐和水:CO2+2NaOH==Na2CO3+H2O(H2CO3+2NaOH==Na2CO3+2H2O)、SO2+2KOH==K2SO3+H2O、H2SO3+2KOH==K2SO3+2H2O、SO3+2NaOH==Na2SO4+H2O、H2SO4+2NaOH==Na2SO4+2H2O
②酸性氧化物跟水反应生成对应的酸:(各元素的化合价不变)、CO2+H20==H2CO3SO2+H2O==H2SO3、SO3+H2O==H2SO4N205+H2O==2HNO3、(说明这些酸性氧化物气体都能使湿润pH试纸变红色)
5、碱和对应的碱性氧化物的联系:
①碱性氧化物和碱都可跟酸反应生成盐和水:CuO+2HCl==CuCl2+H2O、Cu(OH)2+2HCl==CuCl2+2H2O、CaO+2HCl==CaCl2+H2O、Ca(OH)2+2HCl==CaCl2+2H2O
②碱性氧化物跟水反应生成对应的碱:(生成的碱一定是可溶于水,否则不能发生此反应)、K2O+H2O==2KOHNa2O+H2O==2NaOH、BaO+H2O==Ba(OH)2CaO+H2O==Ca(OH)2
③不溶性碱加热会分解出对应的氧化物和水:Mg(OH)2==MgO+H2OCu(OH)2==CuO+H2O、2Fe(OH)3==Fe2O3+3H2O2Al(OH)3==Al2O3+3H2O
相关思维导图模板

树图思维导图提供 流程化上架操作 在线思维导图免费制作,点击“编辑”按钮,可对 流程化上架操作 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:f97bd01986010350f781d05268e8f812

树图思维导图提供 普通家庭高考跨越阶层 在线思维导图免费制作,点击“编辑”按钮,可对 普通家庭高考跨越阶层 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:f3247f4626fdf79ff2dbeb15d8bdaa54












 上海工商
上海工商