高中化学必修知识点总结思维导图

高中跟不上化学科目,原因可能有的同学对于初中化学基础没有扎实,其实没关系,你可以多问老师或者同学,把以前落下的知识进行补补,这样你能更好的进入高中学习状态!你可以抽时间多复习一下初中的知识,下面树图网给
树图思维导图提供 高中化学必修知识点总结 在线思维导图免费制作,点击“编辑”按钮,可对 高中化学必修知识点总结 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:a5285d254b2c64924e40f8dc67026e92
思维导图大纲
高中化学必修知识点总结思维导图模板大纲
高中跟不上化学科目,原因可能有的同学对于初中化学基础没有扎实,其实没关系,你可以多问老师或者同学,把以前落下的知识进行补补,这样你能更好的进入高中学习状态!你可以抽时间多复习一下初中的知识,下面树图网给大家整理了关于高中化学必修知识点总结的内容,欢迎阅读,内容仅供参考!
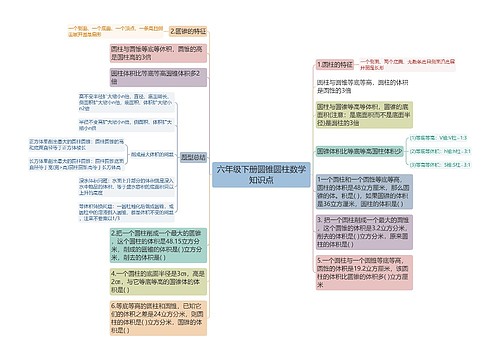
高中化学必修知识点总结
1、在任何的化学反应中总伴有能量的变化。
原因:当物质发生化学反应时,断开反应物中的化学键要吸收能量,而形成生成物中的化学键要放出能量。化学键的断裂和形成是化学反应中能量变化的主要原因。一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小。E反应物总能量>E生成物总能量,为放热反应。E反应物总能量
2、常见的放热反应和吸热反应
常见的放热反应:所有的燃烧与缓慢氧化酸碱中和反应
大多数的化合反应金属与酸的反应
生石灰和水反应(特殊:C+CO22CO是吸热反应)浓硫酸稀释、氢氧化钠固体溶解等
常见的吸热反应:
铵盐和碱的反应如Ba(OH)2·8H2O+NH4Cl=BaCl2+2NH3↑+10H2O
大多数分解反应如KClO3、KMnO4、CaCO3的分解等
以H2、CO、C为还原剂的氧化还原反应如:C(s)+H2O(g)CO(g)+H2(g)。
铵盐溶解等
3.产生原因:化学键断裂——吸热化学键形成——放热
4、放热反应、吸热反应与键能、能量的关系
高中化学必修公式总结
1、Na在空气中加热2Na+O22Na2O2
2、金属Na在空气中表面变灰4Na+O22Na2O
3、Na投入水中,离子方程式2Na+2H2O2Na+2OH+H2↑
4、Al和盐酸反应,离子方程式2Al+6H+2Al3+3H2↑
5、Al和强碱反应,离子方程式2Al+2H2O+2OH-2AlO2+3H2↑
6、Fe与水蒸气反应3Fe+4H2O(g)Fe3O4+4H2
7、过氧化钠与水,指出氧化剂还原剂2Na2O2+2H2O4NaOH+O2↑
氧化剂还原剂都是Na2O2
8、过氧化钠与CO2反应,标出电子转移,指出氧化产物
2Na2O2+2CO22Na2CO3+O2
氧化产物O2
9、小苏打和NaOH混合,离子方程式HCO3+OH-H2O+CO32
10、除去碳酸钠固体中少量的碳酸氢钠杂质2NaHCO3Na2CO3+H2O+CO2↑
11、氧化铝与盐酸反应,离子方程式Al2O3+6H+2Al3+3H2O
12、氧化铝与强碱反应,离子方程式Al2O3+2OH-2AlO2+H2O
13、实验室用铝盐和氨水制备氢氧化铝,离子方程式Al3+3NH3.H2OAl(OH)3↓+3NH4
14、氢氧化铝加NaOH,溶解,离子方程式Al(OH)3+OH-AlO2+2H2O
15、铝盐和过量的强碱混合,无明显现象,离子方程式Al3+4OH-AlO2+2H2O
16、氧化亚铁溶解于盐酸,离子方程式FeO+2H+Fe2+H2O
17、铁盐与过量NaOH混合,离子方程式Fe3+3OH-Fe(OH)3↓
18、白色氢氧化亚铁立刻变为灰绿色,最终变为红褐色
4Fe(OH)2+2H2O+O24Fe(OH)3
19、亚铁盐被氯水氧化2Fe2+Cl22Fe3+2Cl-
20、铁盐和Fe粉混合,溶液由黄色变为浅绿2Fe3+Fe3Fe2+
21、难溶的氢氧化铁加热失水得到相应的碱性氧化物2Fe(OH)3Fe2O3+3H2O
22、Na投入硫酸铜溶液中化学方程式2Na+2H2O+CuSO4Cu(OH)2↓+Na2SO4+H2↑
23、NaHCO3与过量的Ca(OH)2混合,离子方程式HCO3+Ca2+OH-H2O+CaCO3↓
24、用氢氧化钡将明矾溶液中的硫酸根离子沉淀完全
Al3+2SO42+2Ba2+4OH-2BaSO4↓+2AlO2+2H2O
25、硫酸根离子的检验:BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl
26、碳酸根离子的检验:CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl
27、碳酸钠与盐酸反应:Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
28、木炭还原氧化铜:2CuO + C 高温2Cu + CO2↑
29、铁片与硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + Cu
30、氯化钙与碳酸钠溶液反应:CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl
31、钠在空气中燃烧:2Na + O2 △Na2O2 钠与氧气反应:4Na + O2 = 2Na2O
32、过氧化钠与水反应:2Na2O2 + 2H2O = 4NaOH + O2↑
33、过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3 + O2
34、钠与水反应:2Na + 2H2O = 2NaOH + H2↑
35、铁与水蒸气反应:3Fe + 4H2O(g) = F3O4 + 4H2↑
36、铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
37、氧化钙与水反应:CaO + H2O = Ca(OH)2
38、氧化铁与盐酸反应:Fe2O3 + 6HCl = 2FeCl3 + 3H2O
40、氧化铝与盐酸反应:Al2O3 + 6HCl = 2AlCl3 + 3H2O
41、氧化铝与氢氧化钠溶液反应:Al2O3 + 2NaOH = 2NaAlO2 + H2O
42、氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl
43、硫酸亚铁与氢氧化钠溶液反应:FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO4
44、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3
45、氢氧化铁加热分解:2Fe(OH)3 △Fe2O3 + 3H2O↑
46、实验室制取氢氧化铝:Al2(SO4)3 + 6NH3•H2O = 2Al(OH)3↓+ 3(NH3)2SO4
47、氢氧化铝与盐酸反应:Al(OH)3 + 3HCl = AlCl3 + 3H2O
48、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 + NaOH = NaAlO2 + 2H2O
49、氢氧化铝加热分解:2Al(OH)3 △Al2O3 + 3H2O
50、三氯化铁溶液与铁粉反应:2FeCl3 + Fe = 3FeCl2
51、氯化亚铁中通入氯气:2FeCl2 + Cl2 = 2FeCl3
52、氯气与金属铁反应:2Fe + 3Cl2 点燃2FeCl3
53、氯气与金属铜反应:Cu + Cl2 点燃CuCl2
54、氯气与金属钠反应:2Na + Cl2 点燃2NaCl
55、氯气与水反应:Cl2 + H2O = HCl + HClO ↑
56、氯气与氢氧化钠溶液反应:Cl2 + 2NaOH = NaCl + NaClO + H2O
57、氯气与消石灰反应:2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
58、盐酸与硝酸银溶液反应:HCl + AgNO3 = AgCl↓+ HNO3
59、漂白粉长期置露在空气中:Ca(ClO)2 + H2O + CO2 = CaCO3↓+ 2HClO
60、次氯酸光照分解:2HClO 光照2HCl + O2
高中化学必修基本实验
中学化学实验操作中的七原则
1、"从下往上"原则。以Cl2实验室制法为例,装配发生装置顺序是:放好铁架台→摆好酒精灯→根据酒精灯位置固定好铁圈→石棉网→固定好圆底烧瓶。
2、"从左到右"原则。装配复杂装置应遵循从左到右顺序,如上装置装配顺序为:发生装置→集气瓶→烧杯。
3、先"塞"后"定"原则。带导管的塞子在烧瓶固定前塞好,以免烧瓶固定后因不宜用力而塞不紧或因用力过猛而损坏仪器。
4、"固体先放"原则。上例中,烧瓶内试剂MnO2应在烧瓶固定前装入,以免固体放入时损坏烧瓶。总之固体试剂应在固定前加入相应容器中。
5、"液体后加"原则。液体药品在烧瓶固定后加入,如上例中浓盐酸应在烧瓶固定后在分液漏斗中缓慢加入。
6、先验气密性(装入药口前进行)原则。
7、后点酒精灯(所有装置装完后再点酒精灯)原则。
中学化学实验中温度计的使用
1、测反应混合物的温度:这种类型的实验需要测出反应混合物的准确温度,因此,应将温度计插入混合物中间。
①测物质溶解度。
②实验室制乙烯。
2、测蒸气的温度:这种类型实验,多用于测量物质的沸点,由于液体在沸腾时,液体和蒸气的温度相同所以只要测蒸气的温度。
①实验室蒸馏石油。
②测定乙醇的沸点。
3、测水浴温度:这种类型的实验,往往只要使反应物的温度保持相对稳定,所以利用水浴加热,温度计则插入水浴中。
①温度对反应速率影响的反应。
②苯的硝化反应。
相关思维导图模板

树图思维导图提供 1113爆卡会总结会会议纪要 在线思维导图免费制作,点击“编辑”按钮,可对 1113爆卡会总结会会议纪要 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:aaf6c152a765d5821e8e1787f2b3226e

树图思维导图提供 抓住重点 在线思维导图免费制作,点击“编辑”按钮,可对 抓住重点 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:4c49e4799ddf94a339c56e46eb96a826




 上海工商
上海工商