高二化学上册知识点总结思维导图

知识点是网络课程中信息传递的基本单元,研究知识点的表示与关联对提高网络课程的学习导航具有重要的作用。
树图思维导图提供 高二化学上册知识点总结 在线思维导图免费制作,点击“编辑”按钮,可对 高二化学上册知识点总结 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:dbe98f9b791ab4ab2686d569f66ededb
思维导图大纲
高二化学上册知识点总结思维导图模板大纲
知识点是网络课程中信息传递的基本单元,研究知识点的表示与关联对提高网络课程的学习导航具有重要的作用。为了方便大家学习借鉴,下面树图网精心准备了高二化学上册知识点总结内容,欢迎使用学习!
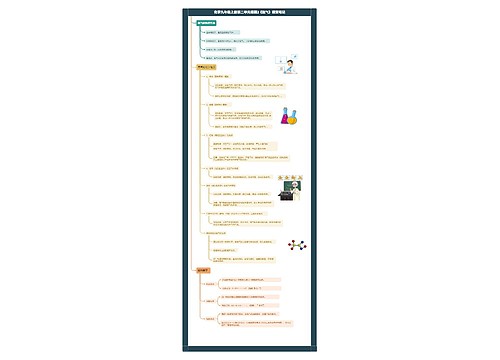
高二化学上册知识点总结
1、人们常用完全污染指数API来表示空气的质量。
空气污染指数:根据空气中二氧化硫(SO2)、二氧化氮(NO2)、可吸入颗粒物等污染物的浓度计算出来的数值。
2、温室气体:CO2、CH4、水蒸气。
温室效应原因:①全球化石燃料用量猛增排放出大量的CO2;②乱砍乱伐导致森林面积急剧减少,吸收CO2能力下降。
3、酸雨PH<5.6的雨水
(1)硫酸型酸雨(2)_型酸雨
SO2的来源:化石燃料及其产品的燃烧、含硫金属矿石的冶炼、硫酸生产的废气等。
NO2的来源:机动车等交通工具的尾气、生产化肥或_等工厂的废气等。(造成的危害除了形成酸雨,还有光化学烟雾、破坏臭氧层等危害。)
4、影响大气质量的主要三个因素是:空气污染、温室效应和臭氧空洞。
5、治理大气污染:
(1)燃煤脱硫:CaCO3CaO+CO2↑CaO+SO2=CaSO32CaSO3+O2=2CaSO4
(2)安装汽车尾气净化装置:2NO+2CON2+2CO2
(3)使用清洁燃料。
(4)静电除尘以防止悬浮颗粒物进入大气。
(5)保护森林资源,增加城市绿地面积等。
6、主要的居室空气污染物:甲醛:对人的皮肤和呼吸器官有强烈的刺激作用。
CO:能和人体的血红蛋白结合,使人体中毒。
7、污水处理中主要的化学方法包括中和法、氧化还原法、沉淀法等。酸性废水一般采用中和法处理;含油类、氰化物、硫化物等污水可用氧化还原法处理;含重金属离子的污水主要用沉淀法处理。
8、天然水的净化处理:
(1)混凝剂除去水中的悬浮颗粒:
常用混凝剂:硫酸铝[Al2(SO4)3]、明矾[KAl(SO4)2·12H2O],基本原理:混凝剂溶于水后生成的胶体可以吸附水的悬浮颗粒并使之沉降。明矾的净水原理:Al3++3H2OAl(OH)3(胶体)+3H+
(2)活性炭吸附某些溶解在水中的杂质,并除去水中的异味。
(3)消毒:常用消毒剂:漂白粉、液氯、臭氧等。
液氯的消毒原理:Cl2+H2OHCl+HClO次氯酸有强氧化性,能杀死水中的细菌。
9、一般生活垃圾分为三类:第一类是有机垃圾(主要指厨余垃圾),第二类是干电池等危险废物,第三类是可回收利用的垃圾。
10、最常用的处理垃圾的方法:封闭式焚烧、卫生填埋。
11、人体中的常量元素:HCNONaMgPSClKCa
12、碘、铁、氟、锌等为微量元素。
(1)儿童缺碘会导致发育迟缓,成人若缺碘容易引起甲状腺肿大,补碘的办法是食用碘盐(碘在碘盐中以KIO3存在)。
(2)人体缺铁,就会患缺铁性贫血。儿童缺铁还可能导致智力发育迟缓。
(3)锌对人的生长发育起关键作用。儿童缺锌导致生长发育不良;老年人缺锌常引起免疫功能退化。
(4)缺氟:造成龋齿,引起老年性骨质疏松
13、人体需要的营养素主要有糖类、油脂、蛋白质、无机盐、维生素和水。
14、糖类:葡萄糖C6H12O6蔗糖C12H22O11淀粉(C6H10O5)n纤维素(C6H10O5)n
葡萄糖和果糖属于单糖。蔗糖、麦芽糖和乳糖属于二糖。淀粉和纤维素属于多糖。单糖不水解,二糖和多糖能发生水解,最终生成单糖。多糖中淀粉、纤维素水解的最终产物都是葡萄糖。淀粉和纤维素均为天然高分子化合物。但淀粉和纤维素并不是同分异构体。
15、植物油、动物脂肪的主要成分是油脂。
油脂:高级脂肪酸和甘油生成的酯。人体摄入油脂后在体内酶的作用下水解生成甘油和高级脂肪酸。(油脂在酸性条件下水解生成高级脂肪酸和甘油,在碱性条件下水解叫做皂化反应,生成高级脂肪酸钠和甘油。)
16、蛋白质中含有C、H、O、N等元素。属天然高分子化合物。
在蛋白质溶液中加入某些浓的轻金属无机盐,如:(NH4)2SO4或Na2SO4等,可使蛋白质的溶解度降低而析出,称为盐析。可用于分离、提纯蛋白质。
在热、强酸、强碱、重金属盐、紫外线、福尔马林(甲醛溶液)作用下,蛋白质的性质会改变而发生凝聚,称为变性。
蛋白质在一定条件下能发生水解反应,最终转化为氨基酸。天然蛋白质的水解产物为α-氨基酸。氨基酸分子中存在氨基(-NH2)和羧基(-COOH)。
构成蛋白质的氨基酸大约20种,其中有8种氨基酸人体不能合成,必须通过食物摄入,被称为必需氨基酸。
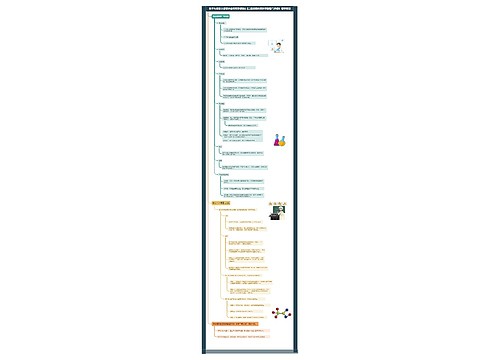
高二化学上册方程式
1,低价态的还原性:
6FeO+O2===2Fe3O4
FeO+4HNO3===Fe(NO3)3+NO2+2H2O
2,氧化性:
Na2O2+2Na===2Na2O
(此反应用于制备Na2O)
MgO,Al2O3几乎没有氧化性,很难被还原为Mg,Al. 一般通过电解制Mg和Al.
Fe2O3+3H2===2Fe+3H2O (制还原铁粉)
Fe3O4+4H2===3Fe+4H2O
3,与水的作用:
Na2O+H2O===2NaOH
2Na2O2+2H2O===4NaOH+O2
(此反应分两步:Na2O2+2H2O===2NaOH+H2O2 ;
2H2O2===2H2O+O2. H2O2的制备可利用类似的反应: BaO2+H2SO4(稀)===BaSO4+H2O2)
MgO+H2O===Mg(OH)2 (缓慢反应)
4,与酸性物质的作用:
Na2O+SO3===Na2SO4
Na2O+CO2===Na2CO3
Na2O+2HCl===2NaCl+H2O
2Na2O2+2CO2===2Na2CO3+O2
Na2O2+H2SO4(冷,稀)===Na2SO4+H2O2
MgO+SO3===MgSO4
MgO+H2SO4===MgSO4+H2O
Al2O3+3H2SO4===Al2(SO4)3+3H2O
(Al2O3是两性氧化物:
Al2O3+2NaOH===2NaAlO2+H2O)
FeO+2HCl===FeCl2+3H2O
Fe2O3+6HCl===2FeCl3+3H2O
Fe2O3+3H2S(g)===Fe2S3+3H2O
Fe3O4+8HCl===FeCl2+2FeCl3+4H2O
高二化学上册重要知识点顺口溜
1.化学反应热概念
化学反应伴能变,成键放出断需要。左能高常是放热,置氢中和和燃烧。炭水铵碱分解类,吸热自然右能高。
2.燃料燃烧知识理解
能源紧张,不久用光。接触充分,空气足量。节能减排,新能跟上。高效清洁,来日方长。
3.化学反应速率概念理解
化学反应有快慢,摩尔每升比时间。平均速率标物质,比例与系数有关。浓度增大我加快,温度升高我翻番。若能出现催化剂,改变大小更不难。
4.化学平衡概念理解
可逆反应有限度,所有转化不完全。正逆速率若相等,化学平衡状态现。此时反应并未停,特征就是动定变。(或:相反相成,可逆平衡;强弱互争,"逃逸"完成;外表内因,宏微相应;量变质变,运动永恒。)
5. 化学平衡
逆等动定变平衡,一等二最六一定, 正逆反应速相等,转产二率最值衡,质量体积 n分数, 浓度温度色一定, 参数可变变不变(变量不变), 定达平衡要记清, 参数一直不变化, 不可用与断平衡。解释:"逆等动定变平衡",是指平衡状态有逆、等、动、定、变五个特征。"一等"是指反应体系中同一反应物(或生成物)的正、逆反应速率相等即达平衡状态。"二最"是指转化率、产率达最大值即达平衡状态。"六一定"是指体系中各组分的质量分数、体积分数、物质的量分数、浓度不再变化,或体系的温度及颜色不再变化即达平衡状态。"参数可变到不变,定达平衡要记清"是指参数(浓度、温度、质量、压强、体积、密度等)原为变量,后变为恒量,此时可逆反应达平衡状态。"参数一直不变化,不可用与断平衡"是指若反应过程中参数始终没有变化,此参数不可用于判断可逆反应是否达平衡状态
6.化学平衡图像题
先拐先折,温度高,压强大!
7.等效平衡
"等效平衡"是指在相同条件下的同一可逆反应里,建立的两个或多个化学平衡中,各同种物质的百分数相同,这些化学平衡均属等效平衡,其核心是"各同种物质的百分数相同"。"等效平衡"常见的有恒温恒压和恒温恒容两种情形,其口诀可概括为:等压比相等;等容量相等,但若系(气体系数)不变,可为比相等【三种情况前提:等T】。
8.酸碱指示剂
石蕊,酚酞,甲基橙,"指示"溶液酸碱性。溶液性呈酸、中、碱,石蕊色变红、紫、蓝。溶液从碱到"中"、"酸",酚酞由红变"无色",变化范围10至8,①碱性"滴"液它直测。②从酸到碱怎知晓?甲基橙显红橙黄;变色范围3至4,酸性"滴"液它可试。注:①10和8指溶液的pH值。②"滴液"指中和滴定达到等当点的溶液。
9.中和滴定1
左手控制塞,右手摇动瓶。眼睛盯溶液,变色立即停。
10.中和滴定2
水液洗器切分明,查漏赶气再调零。待测液中加试剂,左手控制右手动。瓶下垫纸眼观色,读数要与切面平,酚酞示剂常相识,强酸弱碱甲基橙。使用酸式滴定管,不盛碱液切记清。
解释:1、水液洗器切分明:'水'在此有两种含义,既表示自来水,又表示蒸馏水;'液'在此也有两种含义,既表示标准溶液,又表示待测液。这句的意思是说在做中和滴定实验时,必须先对各种仪器进行清洗,而何时用自来水,何时用蒸馏水,何时用标准液,何时用待测液一定要分清分明[联想:滴定管依次用自来水、蒸馏水、标准溶液洗涤;移液管依次用自来水、蒸馏水、待测液洗涤;锥形瓶先用自来水,然后用蒸馏水洗涤即可,切不可用待测液洗涤!]。2、查漏赶气再调零:意思是说滴定前应首先检查滴定管是否漏液,然后检查滴定管下端是否有气泡,若有应赶掉它,最后调节液面至'0'位[联想:(1)查漏的方法是在洗净的滴定管中加少量标准溶液。若漏液,对于酸式滴定管应在活塞上涂适量的凡士林,对于碱式滴定管应更换一下玻璃球;(2)必须赶掉气泡,是因为如果滴定管尖嘴部分有气泡没有赶掉,滴定后气泡消失,则使测定结果偏高;(3)每次滴定最好都从零位开始,这样可以减少误差。]。3、待测液中加试剂:'示剂'指指示剂。意思是说在滴定之前要向盛待测液的锥形瓶中加2-3滴指示剂(其作用是借它的颜色的变化,来指示反应的终点。)。4、左手控制右手动:意思是说在滴定时,必须左手控制滴定管,右手持锥形瓶不断摇动。5、瓶下垫纸眼观色:'瓶下垫纸'的意思是说为了清楚地观察颜色的变化,可以在锥形瓶底下垫一张白纸;'眼观色'的意思是说在滴定过程中要目不转睛地注视着溶液颜色的变化,不要看滴定管的刻度。6、读数要与切面平:解释参见'化学实验基本操作'。7、酚酞示剂常相识,强酸弱碱甲基橙:这句的意思是说中和滴定常用酚酞做指示剂,只有强酸滴定弱碱(如盐酸滴定氨水)时,才能用甲基橙。8、使用酸式滴定管,不盛碱液切记清:这句的意思是说不能用酸式滴定管盛放碱溶液(因为碱液和玻璃中的SiO2反应生成Na2SiO3而使活塞和滴定管粘在一起)。
11.酸碱中和滴定的操作步骤和注意事项
酸管碱管莫混用,视线刻度要齐平。尖嘴充液无气泡,液面不要高于零。莫忘添加指示剂,开始读数要记清。左手轻轻旋开关,右手摇动锥形瓶。眼睛紧盯待测液,颜色一变立即停。数据记录要及时,重复滴定求平均。误差判断看V(标),规范操作靠多练。
11.盐类水解规律口诀
无"弱"不水解,谁"弱"谁水解;越"弱"越水解,都"弱"双水解;谁"强"显谁性,双"弱"由K定。
12.盐类溶解性表规律口诀
钾、钠铵盐都可溶,硝盐遇水影无踪;硫(酸)盐不溶铅和钡,氯(化)物不溶银、亚汞。
13.原电池两种金属作两极,浸入一定电解液,再用导线来联接,产生电流瞬时即,活泼金属电子失,电子流出称负极,化学能量变电能,原始电池创奇迹。
14.电极
电池须称正负极,电解(池)则称阴阳极。电解接负称阴极,电子流从阴极出;电解接正称阳极,离子氧化在阳极。氧化、还原在何极?正负阴阳均须记。
15.电解规律口诀1
惰性材料作电极,两极接通直流电。含氧酸,可溶碱,活动金属含氧盐,电解实为电解水。无氧酸电解自身解,pH变大浓度减。活动金属无氧盐,电解得到相应碱。不活动金属无氧盐,成盐元素两极见;不活动金属含氧盐,电解得到相应酸。非惰性材料作电极,既然电解又精炼;镀件金属作阴极,镀层金属阳极连;阳粗阴纯为精炼,电解液含相应盐。电解都有共同点,阳极氧化阴还原。
16.电解规律口诀2
惰性材料作电极,两极接通直流电。
含氧酸,可溶碱,活动金属含氧盐,
H+和OH—都放电,溶液中水渐减。无氧酸,自身解,pH值变大浓度减。
活动金属无氧盐,电解得到相应碱。不活动金属无氧盐,成盐元素两极见;
不活动金属含氧盐,电解得到相应酸。非惰性材料作电极,既然电解又精炼;
镀件金属作阴极,镀层金属阳极连;阳粗阴纯为精炼,电解液含相应盐。
电解都有共同点,阳极氧化阴极还。
高二化学上册知识点总结相关文章:
★ 关于化学高二知识点归纳笔记
★ 关于高二化学知识点梳理总结
★ 关于高中化学知识点总结归纳(完整版)
★ 有关高中化学基础知识点总结大全
★ 高中化学必修知识点总结归纳精选
★ 高中化学基本知识点归纳大全
★ 关于高中化学知识点总结大全
★ 关于高中化学知识点大全总结
★ 有关高中化学必考知识点2022
相关思维导图模板

树图思维导图提供 1113爆卡会总结会会议纪要 在线思维导图免费制作,点击“编辑”按钮,可对 1113爆卡会总结会会议纪要 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:aaf6c152a765d5821e8e1787f2b3226e

树图思维导图提供 抓住重点 在线思维导图免费制作,点击“编辑”按钮,可对 抓住重点 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:4c49e4799ddf94a339c56e46eb96a826










 上海工商
上海工商