初中化学酸和碱知识点总结思维导图
初三的学生在学习化学这门课程的时候,学会将知识点统摄整理,使之网络化,综合应用,这样才能真正掌握好这门学科。
树图思维导图提供 初中化学酸和碱知识点总结 在线思维导图免费制作,点击“编辑”按钮,可对 初中化学酸和碱知识点总结 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:51c3ba2ae24c174ee93b77de6d0a71e8
思维导图大纲
初中化学酸和碱知识点总结思维导图模板大纲
初三的学生在学习化学这门课程的时候,学会将知识点统摄整理,使之网络化,综合应用,这样才能真正掌握好这门学科。下面树图网给大家整理了关于初中化学酸和碱知识点总结的内容,欢迎阅读,内容仅供参考!
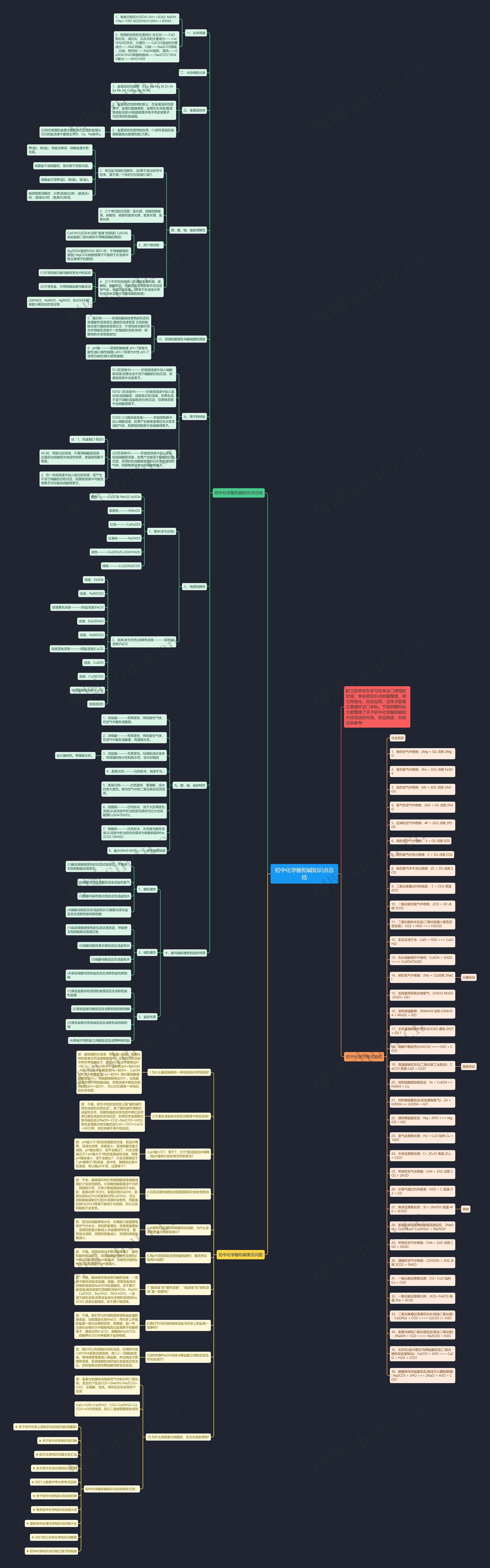
初中化学酸和碱知识点总结
一、化学用语
1、电离方程式H2SO4=2H++SO42-NaOH=Na++OH-Al2(SO4)3=2Al3++3SO42-
2、物质的俗称和主要成分 生石灰——CaO熟石灰、消石灰、石灰水的主要成分——Ca(OH)2石灰石、大理石——CaCO3食盐的主要成分——NaCl纯碱、口碱——Na2CO3烧碱、火碱、苛性钠——NaOH胆矾、蓝矾——CuSO4·5H2O碳酸钠晶体——Na2CO3·10H2O氨水——NH3·H2O
二、化合物的分类
三、金属活动性
1、金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
2、金属活动性顺序的意义:在金属活动性顺序中,金属位置越靠前,金属在水溶液(酸溶液或盐溶液)中就越容易失电子而变成离子,它的活动性就越强。
3、金属活动性顺序的应用:(1)排在氢前的金属能置换出酸里的氢(元素)。
(2)排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来(K、Ca、Na除外)。
四、酸、碱、盐的溶解性
1、常见盐与碱的溶解性:(如果不读出括号中的字,是不是一个较好记忆的顺口溜?)
钾(盐)、钠(盐)、铵盐全都溶,硝酸盐遇水影无踪。
硫酸盐不溶硫酸钡,氯化物不溶氯化银。
碳酸盐只溶钾(盐)、钠(盐)、铵(盐)。
碱类物质溶解性:只有(氢氧化)钾、(氢氧化)钠、(氢氧化)钙、(氢氧化)钡溶。
2、八个常见的沉淀物:氯化银、硫酸钡碳酸银、碳酸钡、碳酸钙氢氧化镁、氢氧化铜、氢氧化铁
3、四个微溶物:
Ca(OH)2(石灰水注明"澄清"的原因) CaSO4(实验室制二氧化碳时不用稀硫酸的原因)
Ag2SO4(鉴别SO42-和Cl-时,不用硝酸银的原因) MgCO3(碳酸根离子不能用于在溶液中除去镁离子的原因)
4、三个不存在的物质:所谓的氢氧化银、碳酸铝、碳酸铁五、分解反应发生的条件反应后有气体、水或沉淀生成。(即有不在溶液中存在或在水溶液中不易电离的物质)
(1)不溶性碱只能与酸性发生中和反应
(2)不溶性盐,只有碳酸盐能与酸反应
(3)KNO3、NaNO3、AgNO3、BaSO4不能做复分解反应的反应物
六、溶液的酸碱性与酸碱度的测定
1、指示剂———溶液的酸碱性紫色的石蕊试液遇酸性溶液变红;遇碱性溶液变蓝 无色的酚酞试液只遇碱溶液变红注:不溶性碱与指示剂无作用碱性溶液不一定是碱的溶液(特例:碳酸钠的水溶液显碱性)
2、pH值———溶液的酸碱度 pH>7溶液为酸性(越小酸性越强) pH=7溶液为中性 pH<7溶液为碱性(越大碱性越强)
七、离子的检验
Cl-(在溶液中)———在被测溶液中加入硝酸银溶液,如果生成不溶于硝酸的白色沉淀,则原被测液中含氯离子。
SO42-(在溶液中)———在被测溶液中加入氯化钡(或硝酸钡、或氢氧化钡)溶液,如果生成不溶于硝酸(或盐酸)的白色沉淀,则原被测液中含硫酸根离子。
CO32-(1)(固体或溶液)———在被测物质中加入稀酸溶液,如果产生能使澄清石灰水变浑浊的气体,则原被测物质中含碳酸根离子。
(2)(在溶液中)———在被测溶液中加入氯化钡或硝酸银溶液,如果产生能溶于硝酸的白色沉淀,且同时生成能使澄清的石灰水变浑浊的气体,则原被测溶液中含碳酸根离子。
注:1、在鉴别Cl-和SO
42-时,用氯化钡溶液,不要用硝酸银溶液,这是因为硫酸银为微溶性物质,使鉴别现象不明显。
2、在一未知溶液中加入氯化钡溶液,若产生不溶于硝酸的白色沉淀,则原被测液中可能含银离子也可能含硫酸根离子。
八、物质的颜色
1、固体(多为白色)
黑色———CuOC粉 MnO2 Fe3O4
紫黑色———KMnO4
红色———CuFe2O3
红褐色———Fe(OH)3
蓝色———Cu(OH)2CuSO4·5H2O
绿色———Cu2(OH)2CO3
2、溶液(多为无色)浅绿色溶液———(亚铁盐溶液)FeCl2
溶液、FeSO4
溶液、Fe(NO3)2
溶液黄色溶液———(铁盐溶液)FeCl3
溶液、Fe2(SO4)3
溶液、Fe(NO3)3
溶液蓝色溶液———(铜盐溶液)CuCl2
溶液、CuSO4
溶液、Cu(NO3)2
溶液蓝绿色溶液-CuCl2
溶液(较浓)
九、酸、碱、盐的特性
1、浓盐酸———有挥发性、有刺激性气味、在空气中能形成酸雾。
2、浓硝酸———有挥发性、有刺激性气味、在空气中能形成酸雾,有强氧化性。
3、浓硫酸———无挥发性。粘稠的油状液体。有很强的吸水性和脱水性,溶水时能放
出大量的热。有强氧化性。
4、氢氧化钙———白色粉末、微溶于水。
5、氢氧化钠———白色固体、易潮解,溶水时放大量热。能与空气中的二氧化碳反应而变质。
6、硫酸铜———白色粉末、溶于水后得蓝色溶液(从该溶液中析出的蓝色晶体为五水合硫酸铜CuSO4·5H2O)。
7、碳酸钠———白色粉末,水溶液为碱性溶液(从溶液中析出的白色晶体为碳酸钠晶体Na2CO3·10H2O)
8、氨水(NH3·H2O)———属于碱的溶液
十、酸与碱的通性和盐的性质
1、酸的通性
(1)酸溶液能使紫色的石蕊试液变红,不能使无色的酚酞试液变色。
(2)酸能与活泼金属反应生成盐和氢气
(3)酸能与碱性氧化物反应生成盐和水
(4)酸能与碱反应生成盐和水(5)酸能与某些盐反应生成新的盐和新的酸
2、碱的通性
(1)碱溶液能使紫色的石蕊试液变蓝,并能使无色的酚酞试液变红色
(2)碱能与酸性氧化物反应生成盐和水
(3)碱能与酸反应生成盐和水
(4)某些碱能与某些盐反应生成新的盐和新的碱
3、盐的性质
(1)某些盐能与较活泼的金属反应生成新的盐和金属
(2)某些盐能与酸反应生成新的盐和新的酸
(3)某些盐能与某些碱反应生成新的盐和新的碱
(4)有些不同的盐之间能反应生成两种新的盐
初中化学方程式总结
化合反应
1、镁在空气中燃烧:2Mg + O2 点燃 2MgO
2、铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O4
3、铝在空气中燃烧:4Al + 3O2 点燃 2Al2O3
4、氢气在空气中燃烧:2H2 + O2 点燃 2H2O
5、红磷在空气中燃烧:4P + 5O2 点燃 2P2O5
6、硫粉在空气中燃烧: S + O2 点燃 SO2
7、碳在氧气中充分燃烧:C + O2 点燃 CO2
8、碳在氧气中不充分燃烧:2C + O2 点燃 2CO
9、二氧化碳通过灼热碳层: C + CO2 高温 2CO
10、一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO2
11、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O === H2CO3
12、生石灰溶于水:CaO + H2O === Ca(OH)2
13、无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4?5H2O
14、钠在氯气中燃烧:2Na + Cl2点燃 2NaCl
分解反应
15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O+ O2↑
16、加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 + O2↑
17、水在直流电的作用下分2H2O 通电 2H2↑+ O2 ↑
18、碳酸不稳定而分H2CO3 === H2O + CO2↑
19、高温煅烧石灰石(二氧化碳工业制法):CaCO3 高温 CaO + CO2↑
置换反应
20、铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu
21、锌和稀硫酸反应(实验室制氢气):Zn + H2SO4 == ZnSO4 + H2↑
22、镁和稀盐酸反应:Mg+ 2HCl === MgCl2 + H2↑
23、氢气还原氧化铜:H2 + CuO 加热 Cu + H2O
24、木炭还原氧化铜:C+ 2CuO 高温 2Cu + CO2↑
25、甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O
26、水蒸气通过灼热碳层:H2O + C 高温 H2 + CO
27、焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe + 3CO2↑
其他
28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH + CuSO4 == Cu(OH)2↓ + Na2SO4
29、甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O
30、酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O
31、一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO2
32、一氧化碳还原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO2
33、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O
34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH + CO2 ==== Na2CO3 + H2O
35、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
36、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑
初中化学酸和碱常见问题
1.为什么酸或碱具有一些相似的化学性质呢?
答:酸或碱的水溶液,如盐酸、硫酸、氢氧化钠和氢氧化钙溶液能够导电,这说明这些溶液中存在带电的粒子,例如HCl在水中解离出H+和 Cl-,H2SO4在水中会解离出H+和SO42-;NaOH在水中会解离出Na+和OH-,Ca(OH)2在水中会解离出Ca2+和OH-.我们看到酸都能解离出H+,而碱都能解离出OH-,也就是说虽然有不同的酸或碱,但其溶液中都包含相同的成分H+或OH-,所以它们具有一些相似的化学性质。
2.凡是生成盐和水的反应都是中和反应吗?
答:不是。因为中和反应的定义是"酸和碱作用生成盐和水的反应"。除了酸和碱作用能生成盐和水外,在酸和碱的化学性质中我们还学到过能生成盐和水的反应,如某些非金属氧化物与碱反应(2NaOH+CO2=Na2CO3+H2O);某些金属氧化物与酸反应(CaO+2HCl=CaCl2+H2O)等,但这些都不是中和反应。
3.pH值小于7、等于7、大于7的溶液加水稀释,其pH值将分别出现怎样的变化?
答:pH值小于7的溶液是酸性溶液,若加水稀释,溶液会变稀,浓度变小,溶液的酸性随之减弱,pH值会增大,但不会超过7,只会无限接近于7.pH值大于7的溶液是碱性溶液,同理pH值会减小,但不会超过7,只会无限接近于7.pH值等于7的溶液,显中性,稀释后还是中性溶液,所以其pH不变,还是等于7.
4.石蕊试液和酚酞试液遇到氢氧化铁会变色吗?
答:不会。酸碱指示剂只有遇到酸溶液或碱溶液时才会改变颜色。大多数的酸都是溶于水的,而碱则不同,只有少数碱是能够溶于水的,如:氢氧化钾 (KOH)、氢氧化钠(NaOH)、氢氧化钡Ba(OH)2和氢氧化钙Ca(OH)2。当石蕊和酚酞遇到它们的水溶液时会变色,而氢氧化铁Fe(OH)3等是不能溶于水的碱,所以石蕊和酚酞不会变色。
5.长期敞口放置的浓硫酸和浓盐酸,为什么溶质的质量分数都会减小?
答:因为浓硫酸有吸水性,长期敞口放置易吸收空气中水分,溶剂质量增加,溶液质量增加,溶质的质量分数减小;浓盐酸有挥发性,易挥发出溶质,溶质的质量减少,溶质的质量分数减小。
6.用pH试纸测定溶液的酸碱度时,能否将试纸用水润湿?
答:不能。润湿后相当于将溶液稀释了,酸性和碱性都减弱了。润湿后测定的酸性溶液的pH值比实际溶液的pH值偏大,而碱性溶液的pH值比实际溶液的 pH值偏小。
7."酸溶液"和"酸性溶液","碱溶液"和"碱性溶液"是一回事吗?
答:不是。酸溶液仅指溶质为酸的溶液,一定属于酸性溶液;如盐酸、硫酸。但某些盐类化合物的溶液如NaHSO4也显酸性,却不属于酸溶液;碱溶液指可溶碱的溶液(KOH、NaOH、Ca(OH)2、Ba(OH)2、NH3.H2O),一定属于碱性溶液;但某些盐类化合物的溶液如Na2CO3 溶液也显碱性,却不属于碱溶液。
8.我们平日所说的调味品盐与化学上的盐是一回事吗?
答:不是。我们平日所用的厨房调味品盐指的是食盐,也就是氯化钠(NaCl),而化学上所指的盐是一类化合物的名称,就像酸、碱一样,这类化合物在水中都能电离出金属离子和酸根离子,像氯化钙(CaCl2)、碳酸钠(Na2CO3)、硫酸钾(K2SO4)等都属于盐类物质。
9.如何判断NaOH溶液与稀盐酸之间的反应恰好完全进行?
答:我们可以利用指示剂来完成,在烧杯中加入约10ml氢氧化钠溶液,滴入2~3滴酚酞溶液。再用滴管慢慢滴入稀盐酸,并边滴边不断搅拌溶液,至溶液颜色恰好由红色变成无色为止,此时氢氧化钠与稀盐酸恰好完全反应。
10.为什么将氢氧化钠固体、生石灰密封保存?
答:氢氧化钠固体会吸收空气中的水和二氧化碳,发生如下反应CO2+2NaOH=Na2CO3+H2O,会潮解、变质。同样生石灰会有如下反应
CaO+H2O=Ca(OH)2,CO2+Ca(OH)2=CaCO3+H2O而变质,所以二者都需要密封保存。
初中化学酸和碱知识点总结相关文章:
★ 关于初中化学上册知识点总结归纳(完整版)
★ 关于初中化学知识点归纳
★ 初三化学知识点重点全汇总
★ 关于初中化学必背知识点归纳
★ 2021人教版中考化学考点总结
★ 关于初中化学知识点总结归纳
★ 有关初中化学知识点总结大全
★ 最新初中必背化学知识点归纳大全
★ 2021初三化学必考知识点整理
★ 初中化学知识点归纳之原子的构成
相关思维导图模板


树图思维导图提供 904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查 在线思维导图免费制作,点击“编辑”按钮,可对 904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:10b9a8a2dd2fb4593f8130ef16c320fc

树图思维导图提供 1113爆卡会总结会会议纪要 在线思维导图免费制作,点击“编辑”按钮,可对 1113爆卡会总结会会议纪要 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:aaf6c152a765d5821e8e1787f2b3226e






 上海工商
上海工商