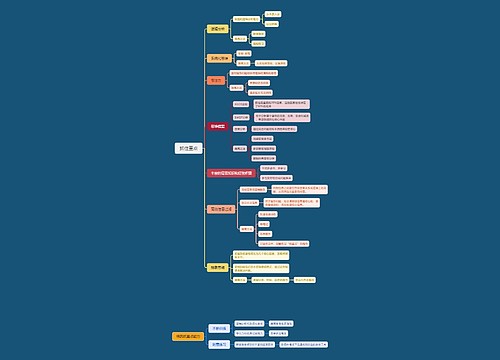
初三化学酸和碱知识点思维导图

在初三复习化学时,很多同学由于之前没有对知识进行总结梳理导致复习时效率不高。
树图思维导图提供 初三化学酸和碱知识点 在线思维导图免费制作,点击“编辑”按钮,可对 初三化学酸和碱知识点 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:00ced2987fa9e5e83c772ddef563471f
思维导图大纲
初三化学酸和碱知识点思维导图模板大纲
在初三复习化学时,很多同学由于之前没有对知识进行总结梳理导致复习时效率不高。为了方便大家学习借鉴,下面树图网精心准备了初三化学酸和碱知识点内容,欢迎使用学习!
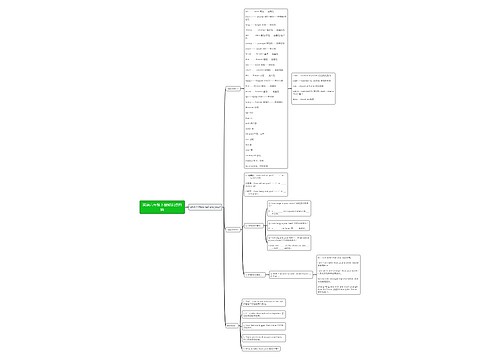
初三化学酸和碱知识点
一、酸、碱、盐的组成
酸是由氢元素和酸根组成的化合物 如:硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3)
碱是由金属元素和氢氧根组成的化合物 如:氢氧化钠、氢氧化钙、氨水(NH3·H2O)
盐是由金属元素元素(或铵根)和酸根组成的化合物 如:氯化钠、碳酸钠
酸、碱、盐的水溶液可以导电(原因:溶于水时离解形成自由移动的阴、阳离子)
二、酸
1、浓盐酸、浓硫酸的物理性质、特性、用途
浓盐酸 浓硫酸
颜色、状态 "纯净":无色液体工业用盐酸:黄色(含Fe3+) 无色粘稠、油状液体
气味 有刺激性气味 无
特性 挥发性(敞口置于空气中,瓶口有白雾) 吸水性 脱水性强氧化性 腐蚀性
用途 ①金属除锈②制造药物③人体中含有少量盐酸,助消化 ①金属除锈②浓硫酸作干燥剂③生产化肥、精炼石油
2、酸的通性(具有通性的原因:酸离解时所生成的阳离子全部是H+)
(1)与酸碱指示剂的反应: 使紫色石蕊试液变红色,不能使无色酚酞试液变色
(2)金属 + 酸 → 盐 + 氢气
(3)碱性氧化物 + 酸 → 盐 + 水
(4)碱 + 酸 → 盐 + 水
(5)盐 + 酸 → 另一种盐 + 另一种酸(产物符合复分解条件)
3、三种离子的检验
试剂
Cl- AgNO3 及HNO3
SO42- ①Ba(NO3)2及HNO3②HCl 及BaCl2
CO32- HCl 及石灰水
三、碱
1、氢氧化钠、氢氧化钙的物理性质、用途
氢氧化钠 氢氧化钙
颜色、状态 白色固体,极易溶于水(溶解放热) 白色粉末,微溶于水
俗名 烧碱、火碱、苛性钠(具有强腐蚀性) 熟石灰、消石灰
制法 Ca(OH)2+Na2CO3== CaCO3↓+2NaOH CaO +H2O== Ca(OH)2
用途 ①氢氧化钠固体作干燥剂②化工原料:制肥皂、造纸③去除油污:炉具清洁剂中含氢氧化钠 ①工业:制漂白粉②农业:改良酸性土壤、配波尔多液③建筑:
2、碱的通性(具有通性的原因:离解时所生成的阴离子全部是OH-)
(1)碱溶液与酸碱指示剂的反应: 使紫色石蕊试液变蓝色,使无色酚酞试液变红色
(2)酸性氧化物+碱 → 盐+水
(3)酸+碱 → 盐+水
(4)盐+碱 → 另一种盐+另一种碱(反应物均可溶,产物符合复分解条件)
注:①难溶性碱受热易分解(不属于碱的通性)
如Cu(OH)2 ΔCuO +H2O
2Fe(OH)3 ΔFe2O3+3H2O
②常见沉淀:AgCl↓ BaSO4↓ Cu(OH)2↓ F e(OH)3↓ Mg(OH)2↓ BaCO3↓ CaCO3↓
③复分解反应的条件:当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。
四、酸性氧化物与碱性氧化物
酸性氧化物 碱性氧化物
定义 凡能与碱反应生成盐和水的氧化物大多数非金属氧化物是酸性氧化物大多数酸性氧化物是非金属氧化物 凡能与酸反应生成盐和水的氧化物大多数金属氧化物是碱性氧化物所有碱性氧化物是金属氧化物
化学性质 (1)大多数可与水反应生成酸CO2+H2O== H2CO3SO2+H2O== H2SO3SO3+H2O== H2SO4 (1)少数可与水反应生成碱Na2O +H2O== 2NaOHK2O +H2O== 2KOHBaO +H2O== Ba(OH)2CaO +H2O== Ca(OH)2
(2) 酸性氧化物+碱 → 盐+水CO2 +Ca(OH)2== CaCO3↓+H2O(不是复分解反应)
(2) 碱性氧化物+酸 → 盐+水Fe2O3+6HCl== 2FeCl3+3H2O
初三化学酸和碱易错易混知识点
1.水是弱电离的,水可以电离出极少量的氢离子和氢氧根,这是一个可逆的过程
2.碳酸钠不是酸也不是碱,而是盐,只是在水中显碱性
3.石蕊遇酸变红,遇碱变蓝,酚酞遇酸不变色,遇碱变蓝,不行搞错,另:它们都是化学变化
4.将石蕊参加酸中,是石蕊变红而不是酸变红
5.酸和碱都有肯定的腐蚀性,使用时要留意,酸碱的腐蚀是化学变化
6.稀释浓硫酸不行以将水倒入硫酸中,应将酸入水,沿容器壁缓缓倒下,同时不断搅拌,不行以用量筒稀释浓硫酸
7.浓盐酸在空气中生成白雾是由于浓盐酸有极强的挥发性(初中常见的酸除了硫酸都有挥发性),是物理变化
8.氨水是一种碱,在水中能电离出铵根离子和氢氧根离子
9.在初中阶段,全部的酸和碱之间都可以发生反响生成盐和水
10.碱和非金属氧化物的反响不是复分解反响,金属氧化物和酸的反响是复分解反响
11.复分解反响发生的条件不仅是生成沉淀气体和水,而且要求反响物中"有酸酸可溶,无酸盐碱溶",但碳酸镁可以和氢氧化钠反响,那是由于生成了比碳酸镁更难溶的氢氧化镁
12.在初中阶段,全部生成碳酸的反响一律写为二氧化碳+水,不考虑二氧化碳溶解
13.在初中阶段,大局部碱是不行溶的,只有氢氧化钠、钾、钡、钙(微溶)和氨水可以在溶液中存在,相反,大局部酸是可溶的
14.并非全部的盐都是中性的,碳酸钠是碱性的,硫酸铵是酸性的,碳酸氢钠有较弱的碱性,硫酸氢钠有肯定的酸性。不行溶的物质自身没有酸碱性,但是可以与相应的酸或碱反响
15.含有碳酸根离子的强碱盐溶液中肯定含有氢氧根离子,含有铵根离子的强酸盐溶液中肯定含有氢离子(不考虑水自身的电离)
16.生成盐和水的反响不肯定都是中和反响
17.中和反响都是放热的
18.酸碱度和酸碱性是不同的,酸碱度指的是溶液的酸碱性强弱,酸碱性指的是溶液显酸性还是碱性,pH试纸测量的是酸碱度,指示剂显示的是酸碱性
19.若不慎将盐酸或硫酸弄到手上或衣服上,不行以用氢氧化钠等强碱中和,被强碱烧伤同理
20.酸碱反响的实质是氢离子和氢氧根离子反响生成水
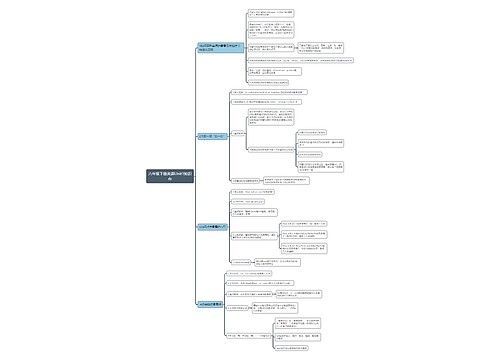
初三化学酸和碱盐解题技法总结
一、除杂题:
1、解答除杂质一类的题目时,要注意三原则;三要领;五种常用的方法。
三原则:①不引入新杂质;②不减少被提纯物质的质量;③杂质便于分离。
三要领:①根据物理性质或化学性质的差异;②确定除杂质方法;③选择适宜试剂。
除杂质思路分析方法:
(1)沉淀法:加入一种试剂将被除去的杂质变为沉淀,再用过滤法除去。
(2)化气法:加热或加入一种试剂将杂质变为气体逸出。
(3)置换法:利用置换反应的原理将杂质除去。
(4)转纯法:将被除去的杂质变为提纯的物质。
(5)吸收法:常用于气体的提纯。
在掌握了以上除杂质的原则、要领、方法后,解答题目时要审清题目要求,分析理顺思路且与题目要求吻合,才能准确解题。
2. 混合物的分离:
(1)可溶性与难溶性物质的混合物——常用溶解、过滤、蒸发三步操作加以分离,分别得到纯净物。如:粗盐的提纯;BaSO4和Na2SO4的混合物。
(2)两种物质均溶于水,但两种物质的溶解度一种随温度变化大,另一种变化不大时,可考虑——结晶法。即冷却热饱和溶液的方法加以分离。如:NaCl和KNO3的混合物。
(3)两种物质均溶于水时,可考虑用化学方法分离。如BaCl2和NaCl的混合物。可将混合物先溶于水,加入适量Na2CO3溶液,得到BaCO3和NaCl溶液。BaCl2+ Na2CO3=BaCO3↓+2NaCl。将沉淀过滤出,洗净后在沉淀中加入适量盐酸溶液,又得到BaCl2溶液,CO2逸出。BaCO3+2HCl =BaCl2+H2O+CO2↑。最后分别将NaCl溶液和BaCl2溶液蒸发,分别得到纯净的NaCl固体和BaCl2固体。
注意:用化学方法或用物理方法进行混合物分离时,要区别除杂质与分离物质的不同点是:除杂质时只要求把杂质除掉、保留原物质即可;而混合物分离是几种物质用一定的方法分开,原混合物中各成分都必须保留。
二、共存的问题(相互间不能发生复分解反应的离子间能共存)
1、在溶液中不能共存的:
a.能反应的酸碱盐
b.活泼的金属和酸
c.活泼的金属和不活泼的金属的盐溶液
2、加隐含条件的应用规律:
生成难溶物或微溶物:如SO42-与Ba2+、Ag+;OH-与Cu2+、Fe3+、Mg2+、Al3+;Ag+与Cl-、CO32-、SO32-、S2-;Mg2+、Ba2+、Ca2+与CO32-、SO32-、PO43-等不能大量共存
生成气体或挥发性物质:如NH4+与OH-,H+与CO32-、HCO3-等不能大量共存。
生成水:OH-与H+不能大量共存
3、附加隐含条件的应用规律:
(1)溶液无色透明时,则溶液中肯定没有有色离子。常见的有色离子是Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(黄棕色)、MnO4-(紫色)。
(2)碱性溶液中肯定不存在与OH-起反应的离子;酸性溶液中肯定不存在与H+起反应的离子。酸性溶液、pH=1的溶液、能使pH试纸变红的溶液、使石蕊试液变红等,在分析各选项组的离子时,还需考虑H+的存在;碱性溶液、pH=14的溶液、能使pH试纸变蓝的溶液,使石蕊试液变蓝或使酚酞试液变红的溶液等;在分析各选项组的离子时,还需考虑OH-的存在。
(3)能与金属反应产生H2的溶液、在分析各选项组的离子时,还需考虑H+或OH-的存在
A.分析问题时还要看清楚题目要求回答的是能大量共存还是不能大量共存,不要选出相反的答案。
B.分析问题时,要逐一找出,同时满足要求。
三、物质的鉴别:
鉴别是通过化学实验将几种不同特性的物质区别开来。如鉴别两瓶无色溶液哪瓶是NaCl或KNO3。我们只要把NaCl溶液中的Cl-检验出来,即可认定NaCl溶液,另一瓶则是KNO3溶液。
1.常见离子鉴别的特效试剂
H+和OH-: 紫色石蕊试液或pH试纸。
OH-: 无色酚酞试液(可鉴别碱性溶液)——变红。
Cl-: AgNO3溶液和稀HNO3——有白色沉淀。
SO42-: BaCl2溶液和稀HNO3——有白色沉淀。
CO32-: 稀HCl和石灰水——有CO2↑。
NH4+: 强碱溶液(NaOH)——有NH3↑。使湿润红色石蕊试纸变蓝。
2.物质鉴别的原则
① 操作简便:能用物理方法鉴别的不用化学方法。能用一种试剂鉴别的不用多种试剂。
② 现象明显:使待检物质的现象对比度较大。
③ 防止干扰:鉴别Cl-和SO42-时,只能用BaCl2溶液不能用AgNO3溶液。
3.物质鉴别的思路和方法
① 气体鉴别:一看颜色,二用试纸,三用火点,四加试剂。
② 固体、液体鉴别:一看颜色,二看气体,三辨沉淀。
③ 一种试剂的鉴别:
A. 几种溶液含不同阳离子时,常选用Ba(OH)2溶液或NaOH溶液做鉴别试剂。
B. 几种溶液含不同阴离子时,常选用强酸做鉴别试剂。
C. 几种溶液酸碱性不同时,常选用紫色石蕊做鉴别试剂。
D. 几种物质是金属或金属氧化物时,常选用稀强酸做鉴别试剂。
E. 一种试剂与四种溶液反应时,应是现象对比度大。多数是有沉淀、有气体,既有沉淀又有气体、沉淀颜色不同,无明显现象。
F. 当给定的一种试剂不能鉴别出被检物时,可从已鉴别出的物质中找出一种试剂再鉴别。
④ 不同试剂的鉴别:
A. 观察法:根据物理性质中颜色、气味、状态、溶解性等进行鉴别。
B. 热分解法:根据不同物质的热稳定性,利用产物的不同性质特征进行鉴别。
C. 相互作用法:根据两两混合后的不同现象进行鉴别。
四、推断题"突破口"
1.从物质的特征入手
(1)有色固体
① 黑色:黑色单质C、Fe粉、 黑色混合物CuO、Fe3O4、MnO2
② 红色:Cu(紫红色)、Fe2O3(红棕色)
③ 蓝色沉淀:Cu(OH)2 ;红褐色沉淀:Fe(OH)3
④ KMnO4(暗紫色或紫黑色)、红磷(暗红色)
(2)有色溶液:Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(黄色)
(3)无色气体:N2、CO2、CO、O2、H2、CH4
(4)有刺激性气味的气体:NH3(此气体可使湿润pH试纸变蓝色)、SO2
2.从化学之最入手
地壳中含量最多的金属元素是铝;最常见的金属是铁;密度最小的气体是氢气;
相对分子质量最小的氧化物是水;最常见的有机物是甲烷CH4
3.物质的用途
(1)改良酸性土壤的物质:Ca(OH)2、CaO;
(2)配置农药波尔多液的物质:CuSO4、Ca(OH)2
(3)胃酸的主要成分:HCl; (4)常用的调味品:NaCl; (5)发酵粉的主要成分:NaHCO3
4、常见一些变化的判断:
① 白色沉淀且不溶于稀硝酸或酸的物质有:BaSO4、AgCl(就这两种物质)
② 蓝色沉淀:Cu(OH)2、 CuSO4 + 2NaOH = Cu(OH)2↓+ 2NaCl
③ 红褐色沉淀:Fe(OH)3 FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl;
Fe(OH)2为白色絮状沉淀,但在空气中很快变成灰绿色沉淀,再变成Fe(OH)3红褐色沉淀
④沉淀能溶于酸并且有气体(CO2)放出的:不溶的碳酸盐
⑤ 沉淀能溶于酸但没气体放出的:不溶的碱
⑥ 与血红蛋白结合,有毒的是CO;
⑦ 能溶于盐酸或稀HNO3的白色沉淀有CaCO3、BaCO3;不溶于稀HNO3的白色沉淀有AgCl、BaSO4。
二、化学推断题解题技巧和思路
1.审题:认真审读原理,弄清文意和图意,理出题给条件,深挖细找,反复推敲。
2.分析:抓住关键,找准解题的突破口,突破口也称为"题眼",指的是关键词、特殊现象、物质都特征等等,然后从突破口出发,探求知识间的内在联系,应用多种思维方式,进行严密的分析和逻辑推理,推出符合题意的结果。
3.解答:根据题目的要求,按照分析和推理的结果,认真而全面地解答。
4.检验:得出结论后切勿忘记验证。其方法是将所得答案放回原题中检验,若完全符合,则说明答案正确。若出现不符,则说明答案有误,需要另行思考,推出正确答案。
解推断题应注意:
(1)推理分析要紧扣实验现象,思考时要层次分明。判断的结论要准确,既要明确的肯定,又要明确的否定。
(2)一般情况下,与试题叙述的现象完全吻合的是"一定存在"。与现象不吻合的或有某种物质的存在使现象不正确的物质是"一定不存在"。有某种物质的存在不影响其它反应的现象或自始至终没有参与任何反应的物质是"可能存在"。
初三化学酸和碱知识点相关文章:
★ 初三化学上学期知识点最新大全
★ 初三上学期化学知识点总结大全
★ 初三化学期末考试重点知识归纳
★ 初三化学沪教版知识点最新大全
★ 关于初三化学必考知识点总结
★ 关于初三化学知识点总结大全
★ 初三化学基本知识理论整理大全2021
★ 2021上海初三化学考点知识点
★ 初中化学知识点归纳最新大全
相关思维导图模板


树图思维导图提供 904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查 在线思维导图免费制作,点击“编辑”按钮,可对 904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:10b9a8a2dd2fb4593f8130ef16c320fc

树图思维导图提供 抓住重点 在线思维导图免费制作,点击“编辑”按钮,可对 抓住重点 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:4c49e4799ddf94a339c56e46eb96a826





 上海工商
上海工商