初中化学酸碱盐知识点总结思维导图
知识点也可以通俗的理解为重要的内容。掌握知识点有助于大家更好的学习。
树图思维导图提供 初中化学酸碱盐知识点总结 在线思维导图免费制作,点击“编辑”按钮,可对 初中化学酸碱盐知识点总结 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:54949184f42c91a017bcbedd6177c4c8
思维导图大纲
初中化学酸碱盐知识点总结思维导图模板大纲
知识点也可以通俗的理解为重要的内容。掌握知识点有助于大家更好的学习。为了方便大家学习借鉴,下面树图网精心准备了初中化学酸碱盐知识点总结内容,欢迎使用学习!
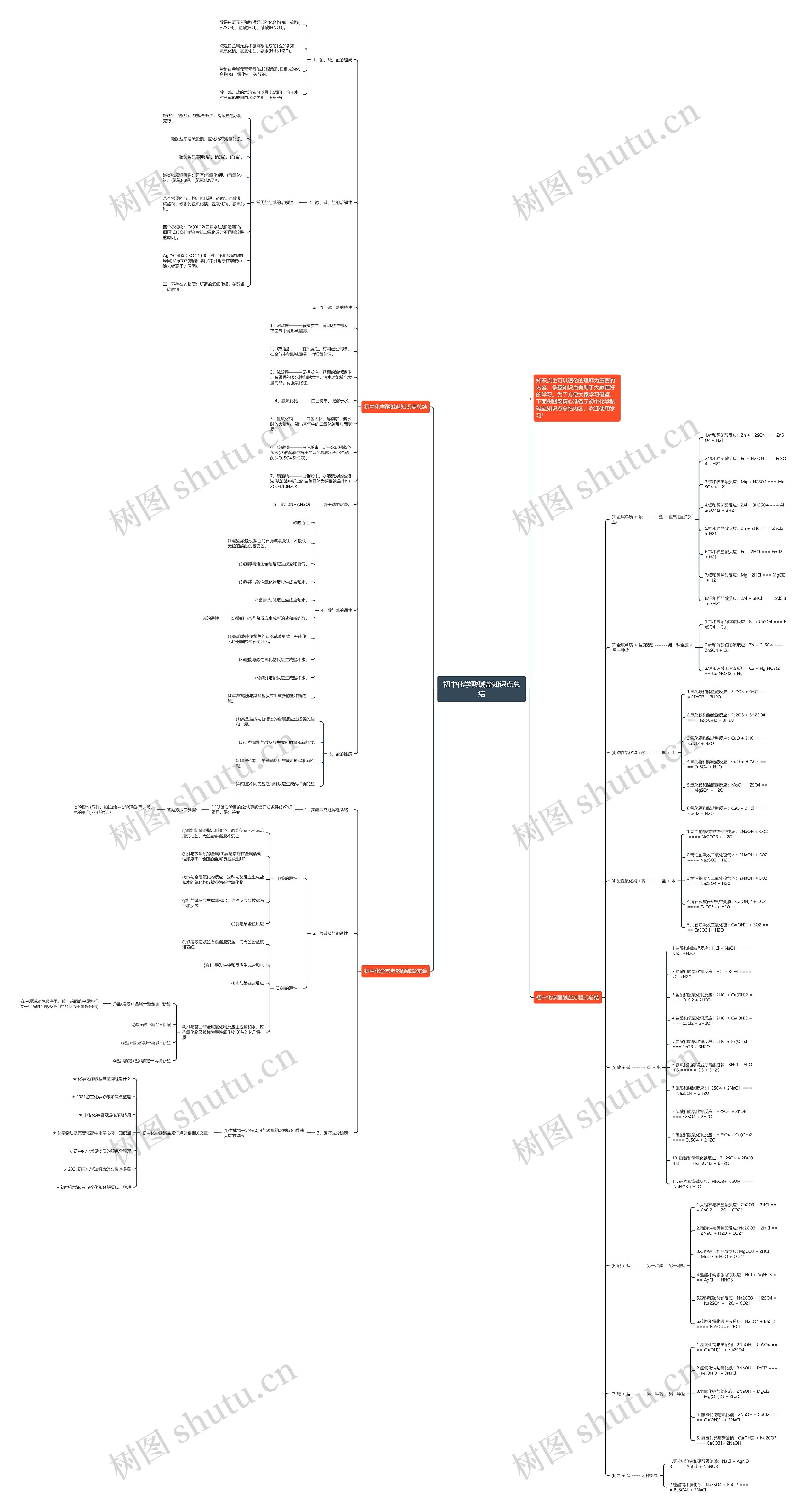
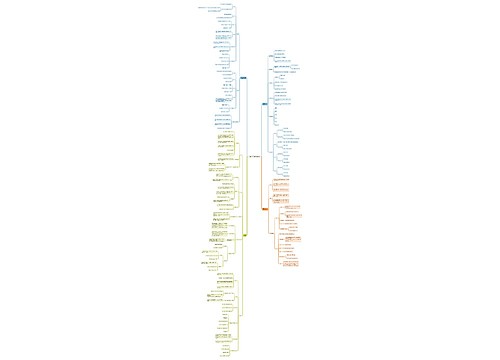
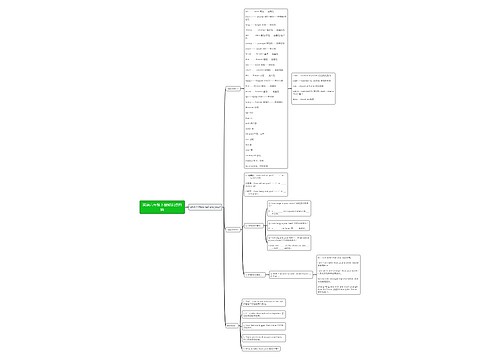
初中化学酸碱盐知识点总结
1、酸、碱、盐的组成
酸是由氢元素和酸根组成的化合物 如:硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3)。
碱是由金属元素和氢氧根组成的化合物 如:氢氧化钠、氢氧化钙、氨水(NH3·H2O)。
盐是由金属元素元素(或铵根)和酸根组成的化合物 如:氯化钠、碳酸钠。
酸、碱、盐的水溶液可以导电(原因:溶于水时离解形成自由移动的阴、阳离子)。
2、酸、碱、盐的溶解性
常见盐与碱的溶解性:
钾(盐)、钠(盐)、铵盐全都溶,硝酸盐遇水影无踪。
硫酸盐不溶硫酸钡,氯化物不溶氯化银。
碳酸盐只溶钾(盐)、钠(盐)、铵(盐)。
碱类物质溶解性:只有(氢氧化)钾、(氢氧化)钠、(氢氧化)钙、(氢氧化)钡溶。
八个常见的沉淀物:氯化银、硫酸钡碳酸银、碳酸钡、碳酸钙氢氧化镁、氢氧化铜、氢氧化铁。
四个微溶物:Ca(OH)2(石灰水注明"澄清"的原因)CaSO4(实验室制二氧化碳时不用稀硫酸的原因)。
Ag2SO4(鉴别SO42-和Cl-时,不用硝酸银的原因)MgCO3(碳酸根离子不能用于在溶液中除去镁离子的原因)。
三个不存在的物质:所谓的氢氧化银、碳酸铝、碳酸铁。
3、酸、碱、盐的特性
1、浓盐酸———有挥发性、有刺激性气味、在空气中能形成酸雾。
2、浓硝酸———有挥发性、有刺激性气味、在空气中能形成酸雾,有强氧化性。
3、浓硫酸———无挥发性。粘稠的油状液体。有很强的吸水性和脱水性,溶水时能放出大量的热。有强氧化性。
4、氢氧化钙———白色粉末、微溶于水。
5、氢氧化钠———白色固体、易潮解,溶水时放大量热。能与空气中的二氧化碳反应而变质。
6、硫酸铜———白色粉末、溶于水后得蓝色溶液(从该溶液中析出的蓝色晶体为五水合硫酸铜CuSO4.5H2O)。
7、碳酸钠———白色粉末,水溶液为碱性溶液(从溶液中析出的白色晶体为碳酸钠晶体Na2CO3.10H2O)。
8、氨水(NH3.H2O)———属于碱的溶液。
4、酸与碱的通性
酸的通性
(1)酸溶液能使紫色的石蕊试液变红,不能使无色的酚酞试液变色。
(2)酸能与活泼金属反应生成盐和氢气。
(3)酸能与碱性氧化物反应生成盐和水。
(4)酸能与碱反应生成盐和水。
(5)酸能与某些盐反应生成新的盐和新的酸。
碱的通性
(1)碱溶液能使紫色的石蕊试液变蓝,并能使无色的酚酞试液变红色。
(2)碱能与酸性氧化物反应生成盐和水。
(3)碱能与酸反应生成盐和水。
(4)某些碱能与某些盐反应生成新的盐和新的碱。
5、盐的性质
(1)某些盐能与较活泼的金属反应生成新的盐和金属。
(2)某些盐能与酸反应生成新的盐和新的酸。
(3)某些盐能与某些碱反应生成新的盐和新的碱。
(4)有些不同的盐之间能反应生成两种新的盐。
初中化学酸碱盐方程式总结
(1)金属单质 + 酸 -------- 盐 + 氢气 (置换反应)
1.锌和稀硫酸反应:Zn + H2SO4 === ZnSO4 + H2↑
2.铁和稀硫酸反应:Fe + H2SO4 === FeSO4 + H2↑
3.镁和稀硫酸反应:Mg + H2SO4 === MgSO4 + H2↑
4.铝和稀硫酸反应:2Al + 3H2SO4 === Al2(SO4)3 + 3H2↑
5.锌和稀盐酸反应:Zn + 2HCl === ZnCl2 + H2↑
6.铁和稀盐酸反应:Fe + 2HCl === FeCl2 + H2↑
7.镁和稀盐酸反应:Mg+ 2HCl === MgCl2 + H2↑
8.铝和稀盐酸反应:2Al + 6HCl === 2AlCl3 + 3H2↑
(2)金属单质 + 盐(溶液) ------- 另一种金属 + 另一种盐
1.铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu
2.锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu
3.铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg
(3)碱性氧化物 +酸 -------- 盐 + 水
1.氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O
2.氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O
3.氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O
4.氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O
5.氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O
6.氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O
(4)酸性氧化物 +碱 -------- 盐 + 水
1.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O
2.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O
3.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O
4.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O
5.消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3 ↓+ H2O
(5)酸 + 碱 -------- 盐 + 水
1.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O
2.盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O
3.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2 + 2H2O
4.盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O
5.盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3 + 3H2O
6.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O
7.硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O
8.硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O
9.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ==== CuSO4 + 2H2O
10. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O
11. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O
(6)酸 + 盐 -------- 另一种酸 + 另一种盐
1.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
2.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑
3.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑
4.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓ + HNO3
5.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑
6.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4 ↓+ 2HCl
(7)碱 + 盐 -------- 另一种碱 + 另一种盐
1.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓ + Na2SO4
2.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl
3.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓ + 2NaCl
4. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓ + 2NaCl
5. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH
(8)盐 + 盐 ----- 两种新盐
1.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 ==== AgCl↓ + NaNO3
2.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl
初中化学常考的酸碱盐实验
1、实验探究题解题战略:
(1)明确实验目的(2)认真阅读已知条件(3)分析题目,得出答案
答题方法三步骤:
实验操作(取样,加试剂)--实验现象(固、液、气的变化)--实验结论
2、酸碱及盐的通性:
(1)酸的通性:
①酸能使酸碱指示剂变色:酸能使紫色石蕊溶液变红色,无色酚酞溶液不变色
②能与较活泼的金属(主要是指排在金属活动性顺序表H前面的金属)反应放出H2
③能与金属氧化物反应,这种与酸反应生成盐和水的氧化物又被称为碱性氧化物
④能与碱反应生成盐和水,这种反应又被称为中和反应
⑤能与某些盐反应
(2)碱的通性:
①碱溶液使紫色石蕊溶液变蓝,使无色酚酞试液变红
②能与酸发生中和反应生成盐和水
③能与某些盐反应
④能与某些非金属氧化物反应生成盐和水,这些氧化物又被称为酸性氧化物(3)盐的化学性质
①盐(溶液)+金属→新金属+新盐
(在金属活动性顺序里,位于前面的金属能把位于后面的金属从他们的盐溶液里置换出来)
②盐+酸→新盐+新酸
③盐+碱(溶液)→新碱+新盐
④盐(溶液)+盐(溶液)→两种新盐
3、废液成分确定:
(1)生成物一定有(2)可能过量的溶质(3)可能未反应的物质
初中化学酸碱盐知识点总结相关文章:
★ 化学之酸碱盐典型例题考什么
★ 2021初三化学必考知识点整理
★ 中考化学复习迎考策略3篇
★ 化学物质及其变化高中化学必修一知识点
★ 初中化学常见物质的颜色全整理
★ 2021初三化学知识点怎么快速提高
★ 初中化学必考19个化和分解反应全整理
相关思维导图模板

树图思维导图提供 1113爆卡会总结会会议纪要 在线思维导图免费制作,点击“编辑”按钮,可对 1113爆卡会总结会会议纪要 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:aaf6c152a765d5821e8e1787f2b3226e

树图思维导图提供 抓住重点 在线思维导图免费制作,点击“编辑”按钮,可对 抓住重点 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:4c49e4799ddf94a339c56e46eb96a826





 上海工商
上海工商