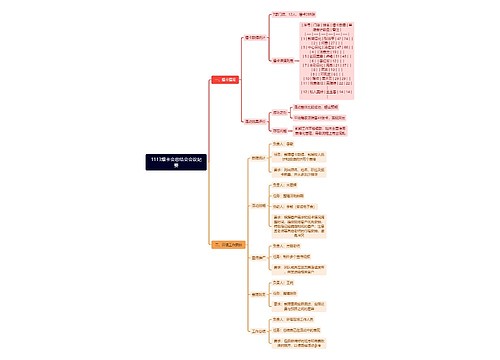
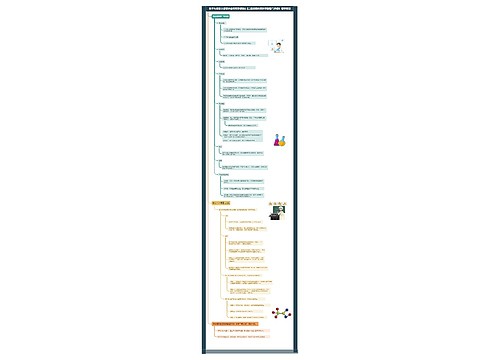
高考化学重要知识点总结思维导图

很多考生在考前都会非常紧张,担心自己复习的不够全面,那么,高考化学有哪些重要知识点?为了方便大家学习借鉴,下面树图网精心准备了高考化学重要知识点总结内容,欢迎使用学习!高考化学重要知识点总结1.固体不一
树图思维导图提供 高考化学重要知识点总结 在线思维导图免费制作,点击“编辑”按钮,可对 高考化学重要知识点总结 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:80ce13e831ca87342826613532ad205f
思维导图大纲
高考化学重要知识点总结思维导图模板大纲
很多考生在考前都会非常紧张,担心自己复习的不够全面,那么,高考化学有哪些重要知识点?为了方便大家学习借鉴,下面树图网精心准备了高考化学重要知识点总结内容,欢迎使用学习!
高考化学重要知识点总结
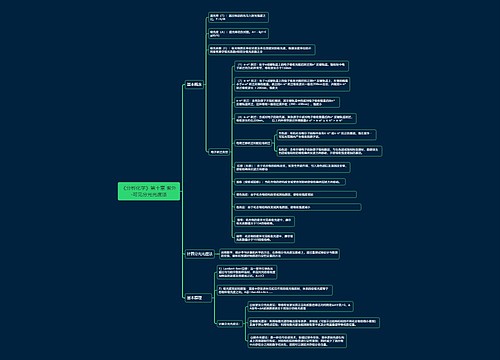
1.固体不一定都是晶体,如玻璃是非晶态物质,再如塑料、橡胶等。
2.最简式相同的有机物:
①CH:C2H2和C6H6
②CH2:烯烃和环烷烃
③CH2O:甲醛、乙酸、甲酸甲酯
④CnH2nO:饱和一元醛(或饱和一元酮)与二倍于其碳原子数和饱和一元羧酸或酯;举一例:乙醛(C2H4O)与丁酸及其异构体(C4H8O2)
3.一般原子的原子核是由质子和中子构成,但氕原子(1H)中无中子。
4.元素周期表中的每个周期不一定从金属元素开始,如第一周期是从氢元素开始。
5.ⅢB所含的元素种类最多。碳元素形成的化合物种类最多,且ⅣA族中元素组成的晶体常常属于原子晶体,如金刚石、晶体硅、二氧化硅、碳化硅等。
6.质量数相同的原子,不一定属于同种元素的原子,如18O与18F、40K与40Ca
7.ⅣA~ⅦA族中只有ⅦA族元素没有同素异形体,且其单质不能与氧气直接化合。
8.活泼金属与活泼非金属一般形成离子化合物,但AlCl3却是共价化合物(熔沸点很低,易升华,为双聚分子,所有原子都达到了最外层为8个电子的稳定结构)。
9.一般元素性质越活泼,其单质的性质也活泼,但N和P相反,因为N2形成叁键。
10.非金属元素之间一般形成共价化合物,但NH4Cl、NH4NO3等铵盐却是离子化合物。
11.离子化合物在一般条件下不存在单个分子,但在气态时却是以单个分子存在。如NaCl。
12.含有非极性键的化合物不一定都是共价化合物,如Na2O2、FeS2、CaC2等是离子化合物。
13.单质分子不一定是非极性分子,如O3是极性分子。
14.一般氢化物中氢为+1价,但在金属氢化物中氢为-1价,如NaH、CaH2等。
15.非金属单质一般不导电,但石墨可以导电,硅是半导体。
16.非金属氧化物一般为酸性氧化物,但CO、NO等不是酸性氧化物,而属于不成盐氧化物。
17.酸性氧化物不一定与水反应:如SiO2。
18.金属氧化物一般为碱性氧化物,但一些高价金属的氧化物反而是酸性氧化物,如:Mn2O7、CrO3等反而属于酸性氧物,2KOH+Mn2O7==2KMnO4+H2O。
19.非金属元素的最高正价和它的负价绝对值之和等于8,但氟无正价,氧在OF2中为+2价。
20.含有阳离子的晶体不一定都含有阴离子,如金属晶体中有金属阳离子而无阴离子。
21.离子晶体不一定只含有离子键,如NaOH、Na2O2、NH4Cl、CH3COONa等中还含有共价键。
22.稀有气体原子的电子层结构一定是稳定结构,其余原子的电子层结构一定不是稳定结构。
23.离子的电子层结构一定是稳定结构。
24.阳离子的半径一定小于对应原子的半径,阴离子的半径一定大于对应原子的半径。
25.一种原子形成的高价阳离子的半径一定小于它的低价阳离子的半径。如Fe3+
26.同种原子间的共价键一定是非极性键,不同原子间的共价键一定是极性键。
27.分子内一定不含有离子键。题目中有"分子"一词,该物质必为分子晶体。
28.单质分子中一定不含有极性键。
29.共价化合物中一定不含有离子键。
30.含有离子键的化合物一定是离子化合物,形成的晶体一定是离子晶体。
31.含有分子的晶体一定是分子晶体,其余晶体中一定无分子。
32.单质晶体一定不会是离子晶体。
33.化合物形成的晶体一定不是金属晶体。
34.分子间力一定含在分子晶体内,其余晶体一定不存在分子间力(除石墨外)。
35.对于双原子分子,键有极性,分子一定有极性(极性分子);键无极性,分子一定无极性(非极性分子)。
36、氢键也属于分子间的一种相互作用,它只影响分子晶体的熔沸点,对分子稳定性无影响。
37.微粒不一定都指原子,它还可能是分子,阴、阳离子、基团(如羟基、硝基等)。例如,具有10e-的微粒:Ne;O2-、F-、Na+、Mg2+、Al3+;OH-H3O+、CH4、NH3、H2O、HF。
38.失电子难的原子获得电子的能力不一定都强,如碳,稀有气体等。
39.原子的最外电子层有2个电子的元素不一定是ⅡA族元素,如He、副族元素等。
40.原子的最外电子层有1个电子的元素不一定是ⅠA族元素,如Cr、ⅠB族元素等。
41.ⅠA族元素不一定是碱金属元素,还有氢元素。
42.由长、短周期元素组成的族不一定是主族,还有0族。
43.分子内不一定都有化学键,如稀有气体为单原子分子,无化学键。
44.共价化合物中可能含非极性键,如过氧化氢、乙炔等。
45.含有非极性键的化合物不一定是共价化合物,如过氧化钠、二硫化亚铁、乙酸钠、CaC2等是离子化合物。
46.对于多原子分子,键有极性,分子不一定有极性,如二氧化碳、甲烷等是非极性分子。
47.含有阳离子的晶体不一定是离子晶体,如金属晶体。
48.离子化合物不一定都是盐,如Mg3N2、金属碳化物(CaC2)等是离子化合物,但不是盐。
49.盐不一定都是离子化合物,如氯化铝、溴化铝等是共价化合物。
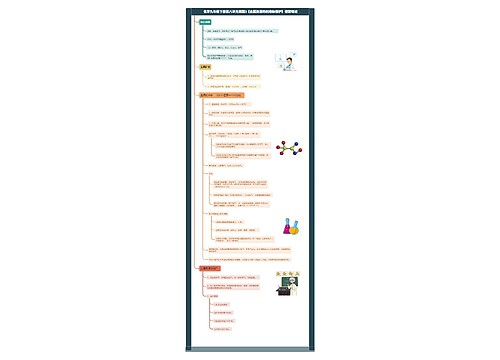
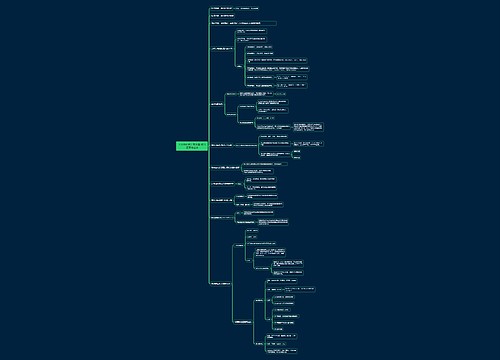
高考化学选择题易错点
1、向某溶液中加入CCl4充分振荡后,CCl4层显紫色,证明原溶液中存在I-(错)。
解析:是单质碘能被CCl4萃取并且溶液显紫色,碘离子不易溶于CCl4也没有颜色。
2、胶体能透过滤纸,浊液不能透过滤纸(错)。
解析:胶体能透过滤纸正确,因为胶体中的分散质微粒和分散剂都能透过滤纸;浊液中的分散质微粒不能透过滤纸,分散剂能够透过滤纸。
3、将同温、同浓度的Na2SO3和Na2CO3溶液,后者的pH较大,证明硫的非金属性强于碳(错)。
解析:只能证明H2SO3的酸性强于H2CO3不能说明硫的非金属性强于碳,因为必须用最高价氧化物的水化物的酸性强弱来证明非金属性的强弱,H2SO4才是硫元素的最高价氧化物的水化物。
4、将胆矾加入到少量蒸馏水中,得到蓝色浊液,加热时浑浊更加明显(对)。
解析:蓝色浊液是铜离子水解生成的氢氧化铜所致,加热时铜离子的水解程度增大,故浑浊更加明显。
5、向紫色石蕊试液中加入过量的过氧化钠粉末,充分振荡,溶液变为蓝色并有气泡冒出(错)。
解析:过氧化钠与水反应生成氢氧化钠使溶液显碱性,故溶液变蓝色,由于过氧化钠具有强氧化性故溶液变蓝后会再褪色。
6、铝热剂溶于足量稀盐酸中,再滴加KSCN溶液,未出现血红色,则该铝热剂中不含氧化铁(错)。
解析:若铝粉过量,氧化铁与盐酸反应生成的Fe3+会被铝还原为Fe2+。
7、实验室可以用排饱和氯化铵溶液的方法来收集氨气(错)。
解析:氨气在水中的溶解度太大,在饱和氯化铵溶液中溶解度虽然略小于在水中的溶解度,但是依然很大,氨气仍然会被饱和氯化铵溶液吸收。
8、将某溶液插入两个电极,通直流电时,溶质粒子一定分别向两极移动(错)。
解析:有些溶质的粒子是不电离的,如蔗糖溶液和酒精溶液的溶质微粒不会向两级移动溶液它们的溶液不导电。
9、S2-具有还原性,SO32-具有氧化性,二者在水溶液中不能共存(错)。
解析:S2-与SO32-在酸性溶液中发生反应:S2-+SO32-+6H+=3S+3H2O,不能大量共存,但是在碱性溶液中不发生反应可以共存。
10、试管内壁残留的银、铜都可以用稀硝酸浸泡洗涤除去(对)。
解析:稀硝酸在常温下就能溶解铜和银生成可溶性的硝酸盐从而除去铜和银,注意不能用浓硝酸,这样消耗硝酸多而且生成的二氧化氮多,污染大。
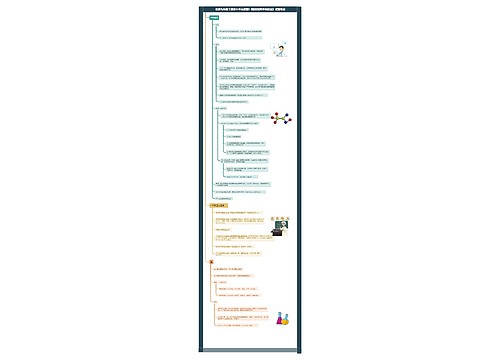
11、由两种不同原子组成的纯净物一定是化合物(错)。
解析:不同的原子可以是互为同位素的两种原子,如18O2与16O2就是由两种不同元素的原子组成的单质。
12、同主族元素的单质的熔点都是随着元素原子序数的递增而逐渐升高的(错)。
解析:不一定是逐渐升高的,如第VIA族元素的单质F2、Cl2、Br2、I2的熔点是逐渐升高的,而Ia族元素中的H2的熔点最低,碱金属元素的单质的熔点随着元素原子序数的递增而逐渐降低的。
13、20℃时,氢氧化钙的溶解度是0.16g,要配制20℃0.5mol/L 的Ca(OH)2溶液480mL,需要使用500mL 的容量瓶(错)。
解析:20℃时,Ca(OH)2的溶解度是0.16g,n[Ca(OH)2]=0.16g/74g/mol =0.00216mol近似地认为100g 水溶解氢氧化钙达到饱和后所得的溶液的体积还是100mL,则饱和石灰水的物质的量浓度为:0.00216mol/0.1L=0.0216mol/L,所以在20℃时,不可能配制出0.5mol/L 的Ca(OH)2溶液。
14、工业上可以用金属钠来制取金属钾,其原理是钠比钾活泼,发生置换反应(错)。
解析:工业上可以用金属钠来制取金属钾的原理是发生置换反应:
KCl+Na≒NaCl+K,不是因为钠比钾活泼,而是由于钾的沸点比钠的沸点低,从反应体系中挥发出来使平衡向右移动,从而使反应得以进行。
15、第二周期元素的原子半径小于第三周期元素的原子半径(错)。
解析:没有说明是同周期元素,不同周期的第二周期元素的原子半径也可以大于第三周期元素的原子半径,如锂原子半径>氯原子半径。
16、加碘盐中含有碘酸钾,而假碘盐中不含碘酸钾,可以用淀粉碘化钾溶液来鉴别真假碘盐(错)。
解析:只有淀粉碘化钾溶液无法鉴别碘酸钾,因为反应
IO3-+5I-+6H+=3I2+3H2O需要在酸性条件下进行。
17、24g 镁单质在足量空气中燃烧固体增重16g(错)。
解析:镁条在空气燃烧时不仅仅跟氧气反应,还会跟氮气以及少量的二氧化碳反应,所以固体质量增加不一定是16g,一般是小于16g,即镁跟氮气的反应的影响其主要作用。
18、在标准状况下,22.4L 三氧化硫中含有的分子数是4NA(错)。
解析:在标准状况下,三氧化硫是固态,22.4L 三氧化硫的物质的量大于1mol。
19、向BaCl2溶液中通入过量的二氧化硫气体,先生成沉淀而后沉淀逐渐消失(错)。
解析:因为氯化钡是盐酸盐,盐酸是强酸,而亚硫酸是弱酸,二者不发生反应,没有沉淀生成。
20、碱性氧化物都是金属氧化物(正确)。
解析:碱性氧化物都是金属氧化物,但是金属氧化物不一定是碱性氧化物,如Al2O3是两性氧化物,Mn2O7是酸性氧化物。
21、常温下铝与浓硫酸不反应,可用作盛放浓硫酸的容器(错)。
解析:不是不反应,而是发生反应形成了致密的氧化膜,阻止了反应继续进行。
22、钠、镁、铁对应的氧化物都是碱性氧化物,铝对应的氧化物是两性氧化物。(错)。
解析:过氧化钠不是碱性氧化物,四氧化三铁是复杂氧化物。
23、配制100mL 质量分数为10%的H2O2溶液:取一个规格为100mL 的容量瓶,量取一定量的质量分数为30%的双氧水溶液,溶于容量瓶中,然后再加水至容量瓶刻度线。(错)
解析:配制一定质量分数的溶液使用烧杯、量筒和玻璃棒即可,不需要使用容量瓶,而且也不能在容量瓶中溶解或稀释溶液。
24、在标准状况下,33.6L 氟化氢中含有的氟原子是1.5NA。(错)
解析:在标准状况下,氟化氢不是气体,33.6L 氟化氢的物质的量不是1.5mol。
25、在标准状况下,2.24L 氯气溶于水中,转移的电子数为0.1NA。(错)
解析:在标准状况下,2.24L 氯气是0.1mol,若0.1mol 氯气完全反应转移的电子数是0.1 NA,但是0.1mol 氯气溶于水中时,与水反应的氯气会小于0.1mol 氯气。
26、向淀粉溶液中加入稀硫酸加热,冷却后再加入新制的氢氧化铜悬浊液,加热,没有发现砖红色沉淀生成,说明淀粉没有水解。(错)
解析:没有用NaOH溶液中和作催化剂的稀硫酸。
27、第三周期主族元素的最高正价数都等于最外层电子数(正确)。
解析:这个说法是正确,氟和氧无正价,但是氟和氧是第二周期的。
28、用饱和碳酸钠溶液可以将BaSO4转化为BaCO3,证明Ksp(BaSO4)>Ksp(BaCO3)(错)。
解析:事实是Ksp(BaCO3) > Ksp(BaSO4),上述转化所以能够进行是因为饱和碳酸钠溶液中CO32-的浓度足够大,c(Ba2+)c(CO32-)> Ksp(BaCO3),从而使沉淀转化。
29、铜与浓硫酸反应时,可以用浸有浓溴水的棉花放在导管口吸收逸出的气体(错)。
解析:浓溴水本身能挥发出有毒的溴蒸气而污染环境。
30、钠、镁、铝都可以通过电解熔融的氯化物的方法制得(错)。
解析:钠和镁是通过电解熔融的氯化物的方法制得的,而铝是通过电解熔融的氧化铝的方法制得的,因为AlCl3是共价化合物,熔融时不电离,无法被电解。
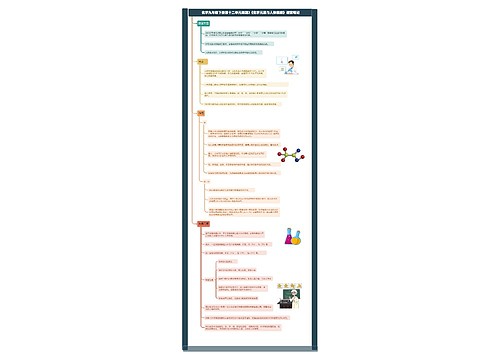
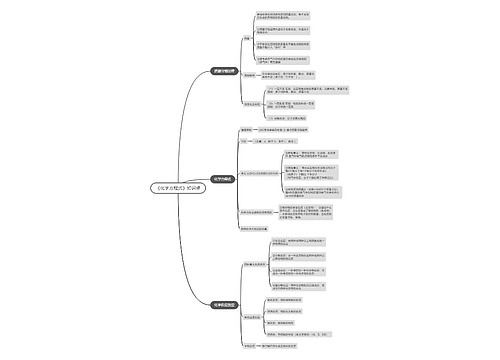
高考化学知识记忆口诀
1.化合价口诀:
(1)常见元素的主要化合价:
氟氯溴碘负一价;正一氢银与钾钠。氧的负二先记清;正二镁钙钡和锌。
正三是铝正四硅;下面再把变价归。全部金属是正价;一二铜来二三铁。
锰正二四与六七;碳的二四要牢记。非金属负主正不齐;氯的负一正一五七。
氮磷负三与正五;不同磷三氮二四。有负二正四六;边记边用就会熟。
一价氢氯钾钠银;二价氧钙钡镁锌,三铝四硅五氮磷;
二三铁二四碳,二四六硫都齐;全铜以二价最常见。
(2)常见根价的化合价
一价铵根硝酸根;氢卤酸根氢氧根。高锰酸根氯酸根;高氯酸根醋酸根。
二价硫酸碳酸根;氢硫酸根锰酸根。暂记铵根为正价;负三有个磷酸根。
2.燃烧实验现象口诀
氧气中燃烧的特点:
氧中余烬能复烯,磷燃白色烟子漫,铁烯火星四放射,硫蓝紫光真灿烂。
氯气中燃烧的特点:
磷燃氯中烟雾茫,铜燃有烟呈棕黄,氢燃火焰苍白色,钠燃剧烈产白霜。
3.氢气还原氧化铜实验口诀
口诀1:氢气早出晚归,酒精灯迟到早退。
口诀2:氢气检纯试管倾,先通氢气后点灯。黑色变红水珠出,熄灭灯后再停氢。
4.电解水口诀
正氧体小能助燃;负氢体大能燃烧。
5.金属活动顺序表口诀
(初中)钾钙钠镁铝、锌铁锡铅氢、铜汞银铂金。
(高中)钾钙钠镁铝锰锌、铬铁镍、锡铅氢;铜汞银铂金。
6.盐类水解规律口诀
无"弱"不水解,谁"弱"谁水解;
愈"弱"愈水解,都"弱"双水解;
谁"强"显谁性,双"弱"由K定。
7.盐类溶解性表规律口诀
钾、钠铵盐都可溶,硝盐遇水影无踪;
硫(酸)盐不溶铅和钡,氯(化)物不溶银、亚汞。
8.化学反应基本类型口诀
化合多变一(A+B→C),分解正相逆(A→B+C),
复分两交换(AB+CD→CB+AD),置换换单质(A+BC→AC+B)。
9.短周期元素化合价与原子序数的关系口诀
价奇序奇,价偶序偶。
10.化学计算
化学式子要配平,必须纯量代方程,单位上下要统一,左右倍数要相等。
质量单位若用克,标况气体对应升,遇到两个已知量,应照不足来进行。
含量损失与产量,乘除多少应分清。
高考化学重要知识点总结相关文章:
★ 2021年理综高考化学知识点总结集合最新
★ 关于高考化学必考知识点总结整理
★ 关于化学高考必考知识点归纳
★ 最新高考化学知识点总结归纳
★ 高考备考化学重点知识点整理2021
★ 高三化学知识点整理五篇2021
★ 高考化学知识点总结完整版大全
★ 理综热点考点高三化学必背知识点归纳2021
★ 高三化学易考基本知识点总结2021
★ 高考化学备考重点知识点2021
相关思维导图模板

树图思维导图提供 1113爆卡会总结会会议纪要 在线思维导图免费制作,点击“编辑”按钮,可对 1113爆卡会总结会会议纪要 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:aaf6c152a765d5821e8e1787f2b3226e

树图思维导图提供 第1章 化工设计基本知识 在线思维导图免费制作,点击“编辑”按钮,可对 第1章 化工设计基本知识 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:70ec0519ed26419068a32a511862aadd








 上海工商
上海工商