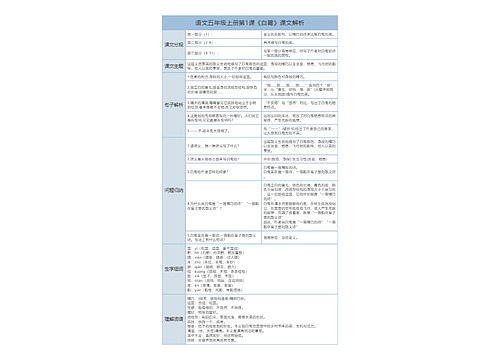
2022中考化学必考知识点汇总思维导图

在中考复习化学时,很多同学由于之前没有对知识进行总结梳理导致复习时效率不高。
树图思维导图提供 2022中考化学必考知识点汇总 在线思维导图免费制作,点击“编辑”按钮,可对 2022中考化学必考知识点汇总 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:7e15ae7aab90c57632cf44b356ef4131
思维导图大纲
2022中考化学必考知识点汇总思维导图模板大纲
在中考复习化学时,很多同学由于之前没有对知识进行总结梳理导致复习时效率不高。下面树图网给大家整理了关于2022中考化学必考知识点汇总的内容,欢迎阅读,内容仅供参考!
中考化学必考知识点汇总
1.气态物质在水中的溶解性
对气态物质来说,除了可以用溶解度来表示其溶解性以外,还可以用"吸收系数"来表示其溶解性(一定温度下单位体积的溶剂所能吸收的气体体积数)。
对中学化学所涉及的气态物质,其溶解性知识的要点是:
1.NH3、HF、HCl、HBr、HI,这几个氢化物都是极易溶的。H2S可溶。
2.单质中F2与水反应,Cl2可溶。
3.氧化物中SO2、CO2、NO2都可溶,并在溶解时会发生反应(NO2的反应特殊)。
4.单质中的稀有气体、O2、N2、H2,不成盐氧化物中的NO和CO,都是微溶或难溶的。
气态有机物的溶解性,应在有机物的部分来讨论。
气体与固体物质溶解性的一个最大不同点是,随温度的升高,所有气体物质的溶解性都会降低。
2.碱、酸、盐及固态氧化物在水中的溶解
1.碱的溶解性:
NH3·H2O、ⅠA族氢氧化物、ⅡA族的Ba(OH)2,都溶于水。
ⅡA族的Ca(OH)2微溶于水。其余氢氧化物大多难溶于水。
2.酸的溶解性:
H2SiO3不溶于水。其余的酸大多溶于水。
3.酸性氧化物及碱性氧化物的溶解性:
对于能与水反应生成相应的可溶性酸或碱的氧化物(见上面的1与2),可以认为是可溶的。
对于不能与水反应的物质(如SiO2),或反应产物不溶于水的(如MgO),应该将其视作为"不溶"。
也就是说,氧化物的溶解性一般要由其相应的碱与酸的溶解性来决定。
4.ⅠA族阳离子的盐,及NH4+盐、NO3-盐、CH3COO-盐,多溶于水。
5.大多数Cl-盐溶于水。但AgCl、Hg2Cl2不溶于水。PbCl2、HgCl2微溶于水。
6.大多数SO42-盐溶于水。但BaSO4、PbSO4不溶于水。CaSO4、Ag2SO4微溶于水。
7.ⅠA族阳离子及NH4+离子的碳酸盐、磷酸盐都溶于水。
其余离子的碳酸盐、磷酸盐都难溶于水。而ⅡA族的HCO3-、H2PO4-盐是可溶于水的。
8.ⅠA族阳离子及NH4+离子的硫化物溶于水。
其余过渡金属的硫化物多难溶。
9.除AgNO3可溶,Ag2SO4微溶外,其余Ag+盐多难溶。
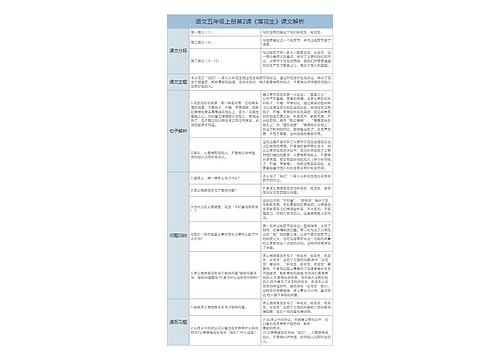
3.溶质的质量分数
一、溶质质量分数的计算基本公式
1.溶质的质量分数:是溶质质量与溶液质量之比。
2.基本公式
溶液的质量=溶液的密度×溶液的体积
溶质质量=溶液密度×溶液体积×溶质质量分数
3、溶液稀释公式
m1ω1=m2ω2或ρ1V1ω1=ρ2V2ω2
(稀释前溶液质量×稀释前溶质质量分数=稀释后溶液质量×稀释后溶质质量分数)
注意牢牢抓住:稀释前溶质质量=稀释后溶质质量
(所加水的质量=稀释后溶液质量-稀释前溶液质量)
二、题型1、溶质的质量分数的简单计算
例题1、在农业生产上,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150 kg的这种溶液,需要氯化钠和水的质量各是多少?
题型2、溶液稀释和配制问题的计算
(1)加水稀释
公式:m1ω1=m2ω2
例题2、把50g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸溶液,需要多少克水?
2)浓溶液和稀溶液混合
关键:浓溶液中的溶质+稀溶液中的溶质=混合后溶液中的溶质
例题3、50g20%的食盐水和多少克溶质质量分数为10%食盐水混合可制得15%的食盐水?
(3)溶液增浓的计算
例题4、有40g溶质质量分数为5%的氯化钙溶液,若将其溶质质量分数增加到10%,可采用什么法?并计算出具体的数值。
A.把溶剂蒸发掉一半
B.加入40g溶质质量分数为10%的氯化钙溶液
C.把溶剂蒸发掉20g
D.加入3g氯化钙晶体
题型3、含有结晶水的物质溶于水制得溶液,溶质质量分数的计算
例题5、将5g胆矾溶于95g水中,求所得溶液的溶质质量分数.
4.溶解的概念解读
1、固体物质的溶解度是指在一定的温度下,某物质在100克溶剂里达到饱和状态时所溶解的克数。在未注明的情况下,通常溶解度指的是物质在水里的溶解度。
2、气体的溶解度通常指的是该气体(其压强为1标准大气压)在一定温度时溶解在1体积水里的体积数。
通常把在室温(20度)下:
溶解度在10g/100g水以上的物质叫易溶物质;
溶解度在1~10g/100g水叫可溶物质;
溶解度在0.01g~1g/100g水的物质叫微溶物质;
溶解度小于0.01g/100g水的物质叫难溶物质.
可见溶解是绝对的,不溶解是相对的。
5.溶解度曲线的应用
1.溶解度曲线上的每一点,代表着某温度下某物质的溶解度,因此利用溶解度曲线可以查出某物质在不同温度下的溶解度,并根据物质的溶解度判断其溶解性。
2.可以比较在同一温度下不同物质溶解度的相 对大小。
3.根据溶解度曲线的形状走向,可以看出某物质的溶解度随温度的变化情况。并根据此情况可以确定从饱和溶液中析出晶体或进行混合物分离提纯的方法。例如:某物质的溶解度曲线"陡",表明该物质溶解度随温度变化明显,提纯或分离该物质时适合采用降温结晶法。某物质溶解度曲线"平缓",提纯或分离该物质时适合采用蒸发溶剂法。
4.从溶解度曲线上的交点,可以判断哪些物质在该点所示的温度下具有相同的溶解度。
5.利用溶解度曲线可以确定一定质量的某物质的饱和溶液降温时析出晶体的质量。
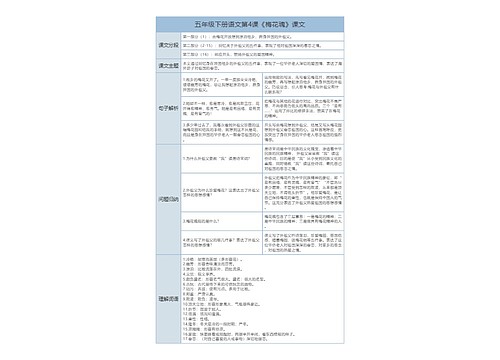
6.物质的溶解性
1、盐的溶解性
含有钾、钠、硝酸根、铵根的物质都溶于水
Cl的化合物只有AgCl不溶于水,其他都溶于水;
含SO42-的化合物只有BaSO4不溶于水,其他都溶于水。
含CO32-的物质只有K2CO3、Na2CO3、(NH4)2CO3溶于水,其他都不溶于水
2、碱的溶解性
溶于水的碱有:氢氧化钡、氢氧化钾、氢氧化钙、氢氧化钠和氨水,其他碱不溶于水。难溶性碱中Fe(OH)3是红褐色沉淀,Cu(OH)2是蓝色沉淀,其他难溶性碱为白色。(包括Fe(OH)2)注意:沉淀物中AgCl和BaSO4不溶于稀硝酸,其他沉淀物能溶于酸。如:Mg(OH)2 CaCO3 BaCO3 Ag2 CO3等
3、大部分酸及酸性氧化物能溶于水,(酸性氧化物+水→酸)大部分碱性氧化物不溶于水,能溶的有:氧化钡、氧化钾、氧化钙、氧化钠(碱性氧化物+水→碱)
7.物质的颜色状态
1、白色固体:MgO、P2O5、CaO、NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态)
2、黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O4▲KMnO4为紫黑色
3、红色固体:Cu、Fe2O3、HgO、红磷▲硫:淡黄色▲Cu2(OH)2CO3为绿色
4、溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈棕黄色,其余溶液一般不无色。(高锰酸钾溶液为紫红色)
5、沉淀(即不溶于水的盐和碱):①盐:白色↓:CaCO3、BaCO3(溶于酸)AgCl、BaSO4(也不溶于稀HNO3)等②碱:蓝色↓:Cu(OH)2红褐色↓:Fe(OH)3白色↓。
6、(1)具有刺激性气体的气体:NH3、SO2、HCl(皆为无色)
(2)无色无味的气体:O2、H2、N2、CO2、CH4、CO(剧毒)
▲注意:具有刺激性气味的液体:盐酸、硝酸、醋酸。酒精为有特殊气体的液体。
7、有毒的,气体:CO液体:CH3OH固体:NaNO2 CuSO4(可作杀菌剂,与熟石灰混合配成天蓝色的粘稠状物质——波尔多液)
8.氧气的性质
(1)单质与氧气的反应:(化合反应)
1.镁在空气中燃烧:2Mg+O2点燃2MgO
2.铁在氧气中燃烧:3Fe+2O2点燃Fe3O4
3.铜在空气中受热:2Cu+O2加热2CuO
4.铝在空气中燃烧:4Al+3O2点燃2Al2O3
5.氢气中空气中燃烧:2H2+O2点燃2H2O
6.红磷在空气中燃烧(研究空气组成的实验):4P+5O2点燃2P2O5
7.硫粉在空气中燃烧:S+O2点燃SO2
8.碳在氧气中充分燃烧:C+O2点燃CO2
9.碳在氧气中不充分燃烧:2C+O2点燃2CO
(2)化合物与氧气的反应:
10.一氧化碳在氧气中燃烧:2CO+O2点燃2CO2
11.甲烷在空气中燃烧:CH4+2O2点燃CO2+2H2O
12.酒精在空气中燃烧:C2H5OH+3O2点燃2CO2+3H2O
(3)氧气的来源:
13.拉瓦锡研究空气的成分实验2HgO加热Hg+O2↑
14.加热高锰酸钾:2KMnO4加热K2MnO4+MnO2+O2↑(实验室制氧气原理1)
加热氯酸钾:2KClO3加热2KCl+3O2↑(实验室制氧气原理2)
15.过氧化氢在二氧化锰作催化剂条件下分解反应:
H2O2 MnO22H2O+O2↑(实验室制氧气原理3)
9.基本概念
1、化学变化:生成了其它物质的变化
2、物理变化:没有生成其它物质的变化
3、物理性质:不需要发生化学变化就表现出来的性质
(如:颜色、状态、密度、气味、熔点、沸点、硬度、水溶性等)
4、化学性质:物质在化学变化中表现出来的性质
(如:可燃性、助燃性、氧化性、还原性、酸碱性、稳定性等)
5、纯净物:由一种物质组成
6、混合物:由两种或两种以上纯净物组成,各物质都保持原来的性质
7、元素:具有相同核电荷数(即质子数)的一类原子的总称
8、原子:是在化学变化中的最小粒子,在化学变化中不可再分
9、分子:是保持物质化学性质的最小粒子,在化学变化中可以再分
10、单质:由同种元素组成的纯净物
10. 实验现象总结
1、镁条在空气中燃烧发出耀眼强光,放出大量热,生成白烟同时生成一种白色物质
2、木条在氧气中燃烧放出白光,放出热量
3、硫在氧气中燃烧发出明亮的蓝紫色火焰,放出热量,生成一种有刺激性气味的气体
4、铁丝在氧气中燃烧剧烈燃烧,火星四射,放出热量,生成黑色固体物质
5、加热试管中碳酸氢铵有刺激性气味气体生成,试管口有液滴生成
6、氢气在氯气中燃烧发出苍白色火焰,产生大量的热,有雾生成
7、在试管中用氢气还原氧化铜黑色氧化铜变为红色物质,试管口有液滴生成
8、用木炭粉还原氧化铜粉末黑色氧化铜变为有光泽的金属颗粒,石灰水变浑浊
9、一氧化碳在空气中燃烧发出蓝色的火焰,放出热量
10、向盛有少量碳酸钾固体的试管中滴加盐酸有气体生成
中考化学记忆顺口溜
1、元素周期表前20个元素
氢氦锂铍硼;
碳氮氧氟氖;
钠镁铝硅磷;
硫氯氩钾钙。
2、化学实验基本操作
固体需匙或纸槽,手贴标签再倾倒。
读数要与切面平,仰视偏低俯视高。
试纸测液先剪小,玻棒沾液测最好。
试纸测气先湿润,粘在棒上向气靠。
酒灯加热用外燃,三分之二为界限。
硫酸入水搅不停,慢慢注入防沸溅。
实验先查气密性,隔网加热杯和瓶。
排水集气完毕后,先撤导管后移灯。
3、过滤操作实验
斗架烧杯玻璃棒,滤纸漏斗角一样。
过滤之前要静置,三靠两低不要忘。
4、氢气还原氧化铜实验
氢气检纯试管倾,先通氢气后点灯。
黑色变红水珠出,熄灭灯后再停氢。
氢气早出晚归,酒精灯迟到早退。
5、重要演示实验
氢在氯中苍白焰,磷在氯中烟雾漫。
甲烷氢气氯相混,强光照射太危险。
二氧碳中镁条燃,两酸遇氨冒白烟。
氯化铵热象升华,碘遇淀粉即变蓝。
硫氢甲烷一氧碳,五者燃烧火焰蓝。
铜丝伸入硫气中,硫铁混热黑物生。
热铜热铁遇氯气,烟色相似皆为棕。
6、酸碱盐
盐酸硫酸和硝酸,全溶于水为强酸。
胃液消化靠盐酸,工业冶金用硫酸。
烟雾炸药靠硝酸,化工化肥很常见。
氢氧化钠为强碱,火碱烧碱苛性钠。
氢氧化钙也常见,石灰建材需要它。
氢氧化铜为蓝色,氢氧化铁红褐色。
常见沉淀氯化银,胃镜透视硫酸钡。
钾钠铵盐硝酸盐,全溶于水不沉淀。
7、金属活动性顺序表
钾钙钠镁铝锌铁,锡铅铜汞银铂金。
8、化合价
一价钾钠氯氢银,二价氧钙钡镁锌,
三铝四硅五价磷;二三铁,二四碳,
二四六硫都齐全;三二四五氮都有,
二四六七锰来占,铜汞二价最常见:
氟氯溴碘本是一,特殊情况为正七。
9、物质溶解性
钾钠铵硝都能溶,盐酸不溶只有银:
硫酸不溶只有钡,微溶还有钙和银;
碳酸大多都不溶,溶铵钾钠微溶银;
碱类大多都不溶,只溶铵钠钾和钡。
10、化学方程式
左写反应物,右写生成物;
中间连等号,条件要注清;
写对化学式,式子要配平;
气体和沉淀,箭号标分明。
11、化学、物理变化
物理变化不难辨,没有新物质出现;
化学变化则不然,物质本身已改变;
两种变化有区别,有无新物作判断;
两种变化有关联,化变中间有物变;
变化都由性质定,物性化性是关键。
12、碳硫磷铁遇氧燃烧
红热木炭剧烈燃烧,发出白光温度很高;
燃硫入氧燃烧变旺,火焰紫色美丽漂亮;
燃磷入氧现象难忘,浓厚白烟冷却粉状;
铁丝燃烧火星四射,生成熔物固态黑色。
13、托盘天平使用
左物右码先调零,天平一定要放平;
砝码大小顺序夹,完毕归零放盒中。
14、仪器装配
下上左右顺序定,装好检验气密性;
固液小大装药品,拆卸仪器反进行。
15、加热
用前检查灯芯平,烧焦过长都不行;
酒精可加三分二,燃着不能加酒精。
点灯要用火柴点,不能用灯去点灯;
熄灯要用灯帽盖,用嘴吹灯祸易生。
16、药品的取用
不摸不凑不口尝,不特说明取小量;
剩余药品别抛弃,切忌再向原瓶装。
17、酒精灯用法
加热使用酒精灯,不能两灯对点灯;
温度最高在外焰,不向燃灯添酒精;
不加热时盖灯帽,严禁用嘴去吹灯。管夹用法
左手拿试管,由下往上夹;
只握长柄把,外焰把热加。
19、容量瓶使用
精确配液容量瓶,用前查洗记心中;
溶解药品用烧杯,静置片刻移瓶中;
转移溶液洗三遍,溶剂一次勿加成;
快到刻度滴管加,摁塞倒立再摇动。
20、检查装置气密性
又手合将容器抱,导管入水出气泡;
手离容器水柱升,方知容器气密好。
中考化学必考的实验
I .测定空气体中的氧含量
1.操作步骤:在气瓶中加入少量水,将水面以上的空间空分成5等份。用止水夹拧紧橡胶软管。点燃燃烧勺里的红磷后。立即放入瓶中,塞紧,观察红磷燃烧情况。红磷熄灭冷却后,打开止水夹,观察实验现象和水面变化。
2.实验现象:产生大量白烟,气瓶内水面上升约1/5体积。
3.实验结论:氧气的体积约为空气体体积的1/5。
4.注意事项:①服用足量或过量的红磷;②实验前检查装置的气密性;(3)止水夹夹紧;(4)点燃红磷后,立即放入瓶中,塞紧;⑤彻底冷却。
二、高锰酸钾制氧
1.操作步骤:检查-安装-设置-点击-接收-离开-熄灭。
2.实验现象:大量气体进入气瓶。
3.实验结论:高锰酸钾可以用来制氧。
4.注意事项:
①试管口略向下倾斜:防止试管因冷凝水回流而破裂。
②药摊在试管底部:加热均匀。
(3)铁夹距管口约1/3。
④胶塞应在导管内稍露:便于气体排出。
⑤试管口处应放一团棉花,防止高锰酸钾粉末进入导管。
⑥用排水法收集时,在气泡均匀连续冒出时收集(先排出试管内的空气体)
⑦实验结束时,先移动导管再熄灭酒精灯:防止水倾泻而下,吸引试管爆裂。
⑧采用向上空气体法收集气体时,导管延伸至气瓶底部。
第三,电解水
1.操作步骤:将两个装满水的试管倒放在一个水槽中,连接起来。
DC供电,观察电极上和试管里发生的情况。切断装置电源,在水下用拇指堵住试管口,取出试管,直立后松开拇指,立即将带火星的木棒放入试管内观察。
2.实验现象:通电后,电极上出现气泡。通电一段时间后,正负极产生的气体体积比约为1: 2。火星扎进正极管的木头燃烧,负极管的气体燃烧,出现淡蓝色火焰。
3.实验结论:水由氢和氧组成。
4.注意:①水中可加入少量硫酸钠或氢氧化钠,以增强导电性。②实验过程开始时,氧气与氢气的体积比不符合1:2,因为氧气不易溶于水,但会溶解一小部分;氢气不溶,反应速度慢,所以氢气少。
4.木炭还原氧化铜
1.操作步骤:将刚烘干的木炭粉和氧化铜粉混合,小心地铺在试管里,将试管固定在铁架上。试管口装有导管,用于引入澄清石灰水,混合物用酒精灯加热几分钟。然后先抽回导气管,待试管冷却后将试管内的粉末倒在纸上,观察现象。
2.实验现象:黑粉逐渐变红,石灰水变浑浊。
3.实验结论:碳具有还原性。
4.注意事项:①反应结束后,将装满石灰水的试管取出,防止液体被吸回试管内,造成热试管爆裂。②实验结束后,不能立即倒出试管中的物质进行观察,以免高温铜与空气体中的氧气反应,重新氧化成氧化铜。
5.一氧化碳还原氧化铜
1.操作步骤:按图示装置将氧化铜放入玻璃管中,先通入co,然后加热,反应结束后停止加热,待玻璃管冷却后停止通入co。
2.实验现象:黑色固体变红,澄清石灰水变浑浊,导管末端产生蓝色火焰。
3.实验结论:一氧化碳具有还原性。
4.注意:实验前应净化一氧化碳。
6.铁的冶炼
1.操作步骤:根据图中所示的装置,将氧化铁放入玻璃管中,然后先通入CO,再加热。反应结束后,先停止加热,待玻璃管冷却后停止CO。
2.实验现象:玻璃管中的粉末由红棕色逐渐变黑,澄清的石灰水变浑浊。
3.实验结论:炼铁的原理是利用一氧化碳和氧化铁的反应。
4.注意:反应后停止加热,冷却后停止通风。
七、铁制品腐蚀条件
1.操作步骤:
(1)在第一个试管中放一个钉子,注入蒸馏水,不要浸没钉子,使钉子接触空气体和水。
(2)在第二个试管中放入一枚钉子,注入刚烧开的蒸馏水(驱赶溶解在水中的空气体)使钉子浸没,然后在水面上加一层植物油,使钉子只与水接触。
(3)用酒精灯吹干第三个试管,放入一个钉子,用橡皮塞塞住试管口,使钉子只与干燥空气体接触。
每天观察指甲生锈情况,认真做好记录。
2.实验现象:ⅰ没有钉子生锈,ⅱ没有钉子生锈,ⅲ没有钉子生锈。
3.实验结论:铁生锈的过程实际上是铁与空气体中的氧气和水蒸气反应的过程。
4.注意:①使用蒸馏水;②应使用干净的不锈钢钉。
2022中考化学必考知识点汇总相关文章:
★ 2021人教版中考化学考点总结
★ 2022中考化学知识点总结归纳大全
★ 中考化学知识点总结大全
★ 初三化学知识点总结2021
★ 2022初中化学必背知识点最新
★ 关于初中化学知识点总结归纳
★ 初三化学中考知识点最新2022年
★ 关于初中化学知识点归纳
★ 人教版初中化学知识点总结最新大全
★ 2021江西中考化学考点归纳
相关思维导图模板


树图思维导图提供 卫生化学--元素和无机物分析 在线思维导图免费制作,点击“编辑”按钮,可对 卫生化学--元素和无机物分析 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:4c942d0350c858e06a1f7ed29a86d096

树图思维导图提供 保研方式汇总 在线思维导图免费制作,点击“编辑”按钮,可对 保研方式汇总 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:3c5f038bdd39e468979ae34ca2a0ab2f







 上海工商
上海工商