高一化学必修二知识点梳理思维导图

其实,不是化学太难,我们学习化学的第一步就是要熟悉课本的内容,将书上重要的知识点理解好。
树图思维导图提供 高一化学必修二知识点梳理 在线思维导图免费制作,点击“编辑”按钮,可对 高一化学必修二知识点梳理 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:fc034bbf0942d8fbe6e61ddba03ce2e5
思维导图大纲
高一化学必修二知识点梳理思维导图模板大纲
其实,不是化学太难,我们学习化学的第一步就是要熟悉课本的内容,将书上重要的知识点理解好。为了方便大家学习借鉴,下面树图网精心准备了高一化学必修二知识点梳理内容,欢迎使用学习!
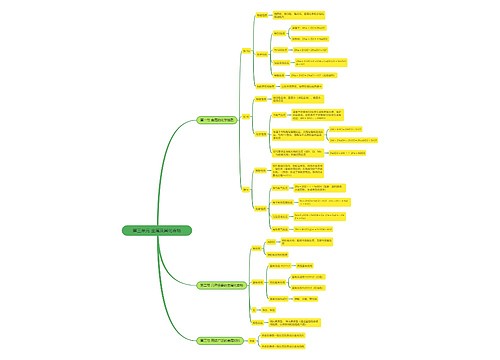
高一化学必修二知识点梳理
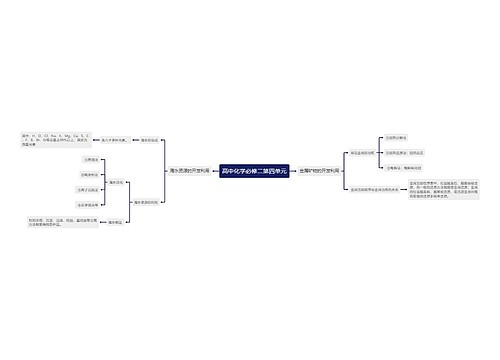
一、原子结构
质子(Z个)
原子核注意: 中子(N个) 质量数(A)=质子数(Z)+中子数(N)
1. 原子序数=核电荷数=质子数=原子的
核外电子(Z个)
★熟背前20号元素,熟悉1~20号元素原子核外电子的排布:
H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca
2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层2最多容纳的电子数是2n;③最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层: 一(能量最低) 二 三 四 五 六 七
对应表示符号: K L M N O P Q
3.元素、核素、同位素
元素:具有相同核电荷数的同一类原子的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。(对于原子来说)
二、元素周期表
1.编排原则:
①按原子序数递增的顺序从左到右排列
②将电子层数相同的各元素从左到右排成一横行。(周期序数=原子的电子层数)
③把最外层电子数相同的元素按电子层数递增的顺序从上到下排成一纵行。
主族序数=原子最外层电子数
2.结构特点:
核外电子层数 元素种类
第一周期 1 2种元素
短周期第二周期 2 8种元素
周期第三周期 3 8种元素
元 7第四周期 4 18种元素
素 7第五周期 5 18种元素周 长周期 第六周期 6 32种元素 期 第七周期 7 未填满(已有26种元素)
表主族:ⅠA~ⅦA共
7个主族
族副族:ⅢB~ⅦB、ⅠB~ⅡB,共7个副族 (18个纵行)第Ⅷ族:三个纵行,位于ⅦB和ⅠB之间 (16个族)零族:稀有气体
三、元素周期律
元素周期律:元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着核电荷数的递增而呈周期性变化的规律。元素性质的周期性变化实质是元素原子核外电子排布的周期性变化的必然结果。
同周期元素性质递变规律 第ⅠA族碱金属元素:Li Na K Rb Cs Fr (Fr是金属性的元素,位于周期表左下方)
第ⅦA族卤族元素:F Cl Br I At (F是非金属性的元素,位于周期表右上方)
★判断元素金属性和非金属性强弱的方法:
(1)金属性强(弱)——①单质与水或酸反应生成氢气容易(难);②氢氧化物碱性强(弱);③相互置换反应(强制弱)Fe+CuSO4=FeSO4+Cu。
(2)非金属性强(弱)——①单质与氢气易(难)反应;②生成的氢化物稳定(不稳定);③价氧化物的水化物(含氧酸)酸性强(弱);④相互置换反应(强制弱)2NaBr+Cl2=2NaCl+Br2。 (Ⅰ)同周期比较:
(Ⅲ)
比较粒子(包括原子、离子)
半径的方法:(1)先比较电子层数,电子层数多的半径大。
(2)电子层数相同时,再比较核电荷数,核电荷数多的半径反而小。
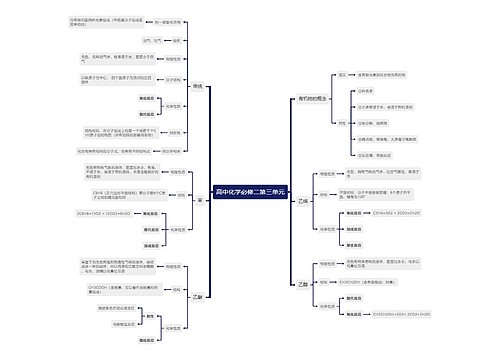
四、化学键
化学键是相邻两个或多个原子间强烈的相互作用。 1.离子键与共价键的比较 共价化合物:原子间通过共用电子对形成分子的化合物叫做共价化合物。(只有共价键)
极性共价键(简称极性键):由不同种原子形成,A-B型,如,H-Cl。
共价键
非极性共价键(简称非极性键):由同种原子形成,A-A型,如,Cl-Cl。
2.电子式:
用电子式表示离子键形成的物质的结构与表示共价键形成的物质的结构的不同点:
(1)电荷:用电子式表示离子键形成的物质的结构需标出阳离子和阴离子的电荷;而表示共价键形成的物质的结构不能标电荷。
(2)[ ](方括号):离子键形成的物质中的阴离子需用方括号括起来,而共价键形成的物质中不能用方括号。
五、在任何的化学反应中总伴有的变化。
原因:当物质发生化学反应时,断开反应物中的化学键要吸收能量,而形成生成物中的化学键要放出能量。化学键的断裂和形成是化学反应中能量变化的主要原因。一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小。E反应物总能量>E生成物总能量,为放热反应。E反应物总能量
六、常见的放热反应和吸热反应
常见的放热反应:①所有的燃烧与缓慢氧化。
②酸碱中和反应。
③金属与酸反应制取氢气。
④大多数化合反应(特殊:C+CO2 △ 2CO是吸热反应)。
△ 常见的吸热反应:①以C、H2、CO为还原剂的氧化还原反应如:C(s)+H2O(g)+H2(g)。 CO(g)
②铵盐和碱的反应如Ba(OH)2·8H2O+NH4Cl=BaCl2+2NH3↑+10H2O
③大多数分解反应如KClO3、KMnO4、CaCO3的分解等。
高一化学必修二知识点易错总结
元素的金属性、非金属性强弱判断规律
(1)金属性强弱的判断依据
①元素的单质与水或酸置换出氢气的反应越容易进行,则其金属性越强。
②元素的最高价氧化物的水化物的碱性越强,则其金属性越强。
③金属元素的单质与盐在水溶液中进行置换反应,若A置换出B,则A的金属性强于B。
④在金属活动性顺序表中,前面的金属性强于后面的。
⑤金属阳离子的氧化性越强,则其单质的还原性越弱,元素的金属性越弱(注:Fe的阳离子仅指Fe2+)。
(2)非金属性强弱的判断依据
①非金属元素的单质与氢气化合生成气态氢化物的反应越容易进行,则其非金属性越强。
②非金属元素气态氢化物的稳定性越强,则元素的非金属性越强。
③元素的最高价氧化物的水化物的酸性越强,则其非金属性越强。
④非金属元素的单质与盐在水溶液中进行置换反应,若A置换出B,并且A体现出氧化性,则A的非金属性强于B。
⑤非金属阴离子的还原性越强,则其单质的氧化性越弱,元素的非金属性越弱。
粒子半径大小的比较——"四同"规律
1.同周期——"序大径小"
(1)规律:同周期,从左往右,原子半径逐渐减小。
(2)举例:第三周期中:r(Na)>r(Mg)>r(Al)>r(Si)>r(P)>r(S)>r(Cl)。
2.同主族——"序大径大"
(1)规律:同主族,从上到下,原子(或离子)半径逐渐增大。
(2)举例:碱金属:r(Li)
3.同元素
(1)同种元素的原子和离子半径比较——"阴大阳小"。
某原子与其离子半径比较,其阴离子半径大于该原子半径,阳离子半径小于该原子半径。
如:r(Na+)r(Cl)。
(2)同种元素不同价态的阳离子半径比较规律——"数大径小"。
带电荷数越多,粒子半径越小。
如:r(Fe3+)
4.同结构——"序大径小"
(1)规律:电子层结构相同的离子,核电荷数越大,离子半径越小。
(2)举例:r(O2-)>r(F-)>r(Na+)>r(Mg2+)>r(Al3+)。
特别提醒所带电荷、电子层均不同的离子可选一种离子参照比较。例:比较r(Mg2+)与r(K+)可选r(Na+)为参照,可知r(K+)>r(Na+)>r(Mg2+)。
同一元素的"位、构、性"关系
元素的原子结构决定了元素在周期表中的位置和元素的主要性质,元素在周期表中的位置反映了元素的原子结构和元素的主要性质,故三者之间可相互推断。
即:元素的原子结构/元素在周期表中的位置/元素的主要性质。
1.结构与位置互推是解题的基础
(1)掌握四个关系式。
①电子层数=周期数。
②质子数=原子序数。
③主族元素原子最外层电子数=主族序数。
④主族元素的最高正价=族序数,
最低负价=主族序数-8。
(2)熟练掌握周期表中的一些特殊规律。
①各周期元素种类数(分别为2、8、8、18、18、32、26)。
②稀有气体元素原子序数(分别为2、10、18、36、54、86)和所在周期(分别在一到六周期)。
③同族上下相邻元素原子序数的关系(相差2、8、18、32等各种情况)。
④同周期ⅡA族与ⅢA族元素原子序数差值(有1、11、25等情况)。
2.性质与位置互推是解题的关键
熟悉元素周期表中同周期、同主族元素性质的递变规律,主要包括:
①原子半径。
②元素的主要化合价。
③元素的金属性、非金属性。
④单质的氧化性、还原性。
⑤气态氢化物的稳定性。
⑥最高价氧化物对应水化物的酸碱性。
⑦金属从H2O或酸中置换H2的难易程度
3.结构和性质的互推是解题的要素
(1)电子层数和最外层电子数决定元素原子的金属性和非金属性强弱。
(2)同主族元素最外层电子数相同,化学性质相似。
(3)正确推断原子半径和离子半径的大小及结构特点。
(4)判断元素金属性和非金属性强弱。
易错点提示
(1)"三个不一定"。
①需加热才能发生的反应不一定是吸热反应,如碳和氧气的反应;
②放热反应常温下不一定容易发生,如铝热反应;
③吸热反应也不一定需要加热,如Ba(OH)2·8H2O晶体和NH4Cl晶体的反应。
(2)吸热反应和放热反应都是化学变化,如NaOH固体溶于水是放热过程,但不是放热反应;如升华、蒸发等过程是吸热过程,但不是吸热反应。
2.常见的放热反应和吸热反应
原电池原理的应用
(1)比较金属活动性
作负极的金属活动性强,作正极的金属活动性弱。
(2)改变化学反应速率
如:在Zn和稀硫酸反应时,滴加少量CuSO4溶液,则Zn置换出的铜和锌能构成原电池的正负极,从而加快Zn与稀硫酸反应的速率。
(3)设计原电池
如:把Fe+2Fe3+===3Fe2+设计成原电池,可用Fe作负极,铜(或石墨)作正极,FeCl3溶液作电解质溶液。
(4)保护金属设备
如:船体是钢铁材料,在海水中易被腐蚀,在船体外壳焊接上比铁活泼的金属(如Zn),则构成以Zn、Fe为电极的原电池,Zn被消耗掉而Fe得到保护。
常见的燃料电池
常见的燃料电池有氢氧燃料电池、甲烷燃料电池、甲醇燃料电池等。燃料电池的正极反应物一般为氧气。电解质不同,电极反应就不同,如氢氧燃料电池以碱为电解质,其放电原理为:
负极(H2)反应式:2H2-4e-+4OH-===4H2O(氧化反应)
正极(O2)反应式:O2+2H2O+4e-===4OH-(还原反应)
电池总反应式:2H2+O2===2H2O
氢氧燃料电池以酸为电解质,其放电原理为:
负极(H2)反应式:2H2-4e-===4H+(氧化反应)
正极(O2)反应式:O2+4H++4e-===2H2O(还原反应)
电池总反应式:2H2+O2===2H2O
化学反应速率影响因素注意点
(1)主要因素(内因)
不同的化学反应,具有不同的反应速率,因此,参加反应的物质的性质是决定化学反应速率的主要因素。
(2)外界因素(外因)
①温度:当其他条件不变时,升高温度,可以增大化学反应速率;降低温度,可以减小化学反应速率。
②催化剂:当其他条件不变时,使用适当的催化剂通常能极大地加快化学反应速率。
③浓度:当其他条件不变时,增大反应物的浓度,可以增大化学反应速率;减小反应物的浓度,可以减小化学反应速率。
④压强:对于有气体参加的反应,当其他条件不变时,增大气体的压强,可以增大化学反应速率;减小气体的压强,可以减小化学反应速率。
⑤固体表面积:固体颗粒越小,其单位质量的表面积越大,与其他反应物的接触面积越大,化学反应速率越大。
⑥反应物状态:一般来说,配成溶液或反应物是气体,都能增大反应物之间的接触面积,有利于增大反应速率。
⑦形成原电池,可以增大氧化还原反应的反应速率。
化学平衡状态的判断
1.直接标志
(1)v(正)=v(逆)。
①同一种物质的生成速率等于消耗速率
②在化学方程式同一边的不同物质的生成速率与消耗速率之比等于化学计量数之比
③在化学方程式两边的不同物质的生成(或消耗)速率之比等于化学计量数之比
(2)各组分的浓度保持一定
①各组分的浓度不随时间的改变而改变
②各组分的质量分数、物质的量分数、体积分数不随时间的改变而改变
2.间接标志
(1)反应体系中的总压强不随时间的改变而变化(适用于反应前后气体体积不等的反应)。
(2)混合气体的密度不随时间的改变而变化(适用于反应前后气体体积不等且无固体、液体参与或生成的反应)。
(3)对于反应混合物中存在有颜色变化的物质的可逆反应,若体系中颜色不再改变,则反应达到平衡状态。
(4)全是气体参加的反应前后化学计量数改变的可逆反应,平均相对分子质量保持不变。
(5)对同一物质而言,断裂化学键的物质的量与形成化学键的物质的量相等。
甲烷发生取代反应的有关规律
(1)反应条件和反应物
反应条件为光照,反应物为卤素单质。例如甲烷与氯水、溴水不反应,但可以与氯气、溴蒸气发生取代反应。
(2)反应产物
虽然反应物的比例、反应的时间长短等因素会造成各种产物的比例不同,反应的产物都是CH3Cl、CH2Cl2、CHCl3和CCl4四种有机物与氯化氢形成的混合物。
(3)物质的量的关系
CH4与Cl2发生取代反应时,每1 mol H原子被取代,消耗1 mol Cl2分子,同时生成1 mol的HCl分子。
(4)注意:
①有机反应比较复杂,常伴随很多副反应发生,因此有机反应方程式常用"―→"。
②CH4与Cl2的反应逐步进行,应分步书写。
③当n(CH4)∶n(Cl2)=1∶1时,反应并不只发生CH4+Cl2CH3Cl+HCl,其他反应仍发生。
解题方法归纳
(1)甲烷的卤代反应的产物是混合物。
(2)甲烷等有机物与氯气发生取代反应时,取代的位置和个数是难以控制的,因此制备卤代烃一般不采用取代反应。
酯与油脂的区别
(1)酯是无机含氧酸或有机羧酸与醇通过酯化反应生成的一类有机物,而"油脂"是高级脂肪酸与丙三醇形成的酯,故"酯"中包含"脂",注意两字的书写,"油脂"不能写为"油酯"。
(2)"油"和"脂"都是高级脂肪酸甘油酯。"油"一般不饱和程度较高,熔点较低,室温下为液态;"脂"一般饱和程度较高,熔点较高,室温下为固态,又称为"脂肪"。油通过氢化可以转化为脂肪。另外,油脂是混合物。
蛋白质的检验
(1)有些蛋白质能与浓硝酸发生颜色反应。此类蛋白质通常含有苯环。
(2)灼烧蛋白质固体时产生烧焦羽毛的气味,原因是分子中含有N、S等元素。
高一化学学习方法
1.规律法。酸性氧化物与碱的反应有两条规律,一是反应产物是盐和水;二是反应前后,各元素的化合价保持不变。在写SO2与NaOH反应生成物的化学式时,有不少同学将结果错写成了"Na2O+S(OH)4"或"Na2SO4+H2O"。前一种错误的错因在于,忽视了规律一,机械套用了复分解反应生成物化学式的书写思路;后一种错误的错因在于,没有注意到S的化合价在反应前后都为+4价,将Na2SO3误写成了平时较为常见的化学式Na2SO4。
2.模仿法。在碳一章中,同学们已经熟悉了二氧化碳通入澄清石灰水反应的化学方程式:CO2+Ca(OH)2==CaCO3↓+H2O。以该反应为模板,我们可以写出二氧化碳与氢氧化钡、氢氧化钠反应后生成物的化学式:BaCO3+H2O;Na2CO3+H2O。
3.添氧法。在初中化学中,最为常见的酸性氧化物有二氧化碳、二氧化硫、三氧化硫三种,这些酸性氧化物与碱溶液反应生成盐中所含的酸根离子往往比酸性氧化物多一个氧原子,因此,在初中阶段,我们可以"添氧法"去确定该类反应所生成盐的化学式。如,氢氧化钠与二氧化碳反应所生成的盐,其化学式是由Na与CO3(CO2增加一个氧原子后变成CO3原子团)组成的Na2CO3;氢氧化钠与三氧化硫反应所生成的盐,其化学式是由Na与SO4(SO3增加一个氧原子后变成SO4原子团)组成的Na2SO4。
4.分步法。某些酸性氧化物与碱溶液的反应,可以看成是分步发生的:第一步是酸性氧化物与水化合成酸;第二步是酸与碱溶液发生中和反应。如,二氧化硫与氢氧化钠溶液的反应,可以看作二氧化硫先与水化合成H2S03,然后,H2S03再与NaOH反应生成Na2SO3+H2O。
高一化学必修二知识点梳理相关文章:
★ 2021高中化学会考详细基础知识重点梳理
★ 高二化学重要知识点整理2021
★ 2021年物质的分类高中化学知识点复习
★ 高一化学必修一主要知识点梳理2022
★ 2021年离子反应高中化学知识点复习
★ 高二化学重要知识难点解读2021
★ 2021年高中必修一化学物质及其变化复习提纲
★ 2021高中化学必修一知识点口诀及解释
相关思维导图模板

树图思维导图提供 人教版必修一:分子与细胞 在线思维导图免费制作,点击“编辑”按钮,可对 人教版必修一:分子与细胞 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:38b99f99a660f9eb846aafd51549cc03

树图思维导图提供 智能体建设方案 在线思维导图免费制作,点击“编辑”按钮,可对 智能体建设方案 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:4c86bd238ee6e1c35b7ad73e00cfe9da




 上海工商
上海工商