第五章 酶的稳定化思维导图
第五章 酶的稳定化
树图思维导图提供 第五章 酶的稳定化 在线思维导图免费制作,点击“编辑”按钮,可对 第五章 酶的稳定化 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:146be2d13e4a083c94a838c4e99b534b
思维导图大纲
第五章 酶的稳定化思维导图模板大纲
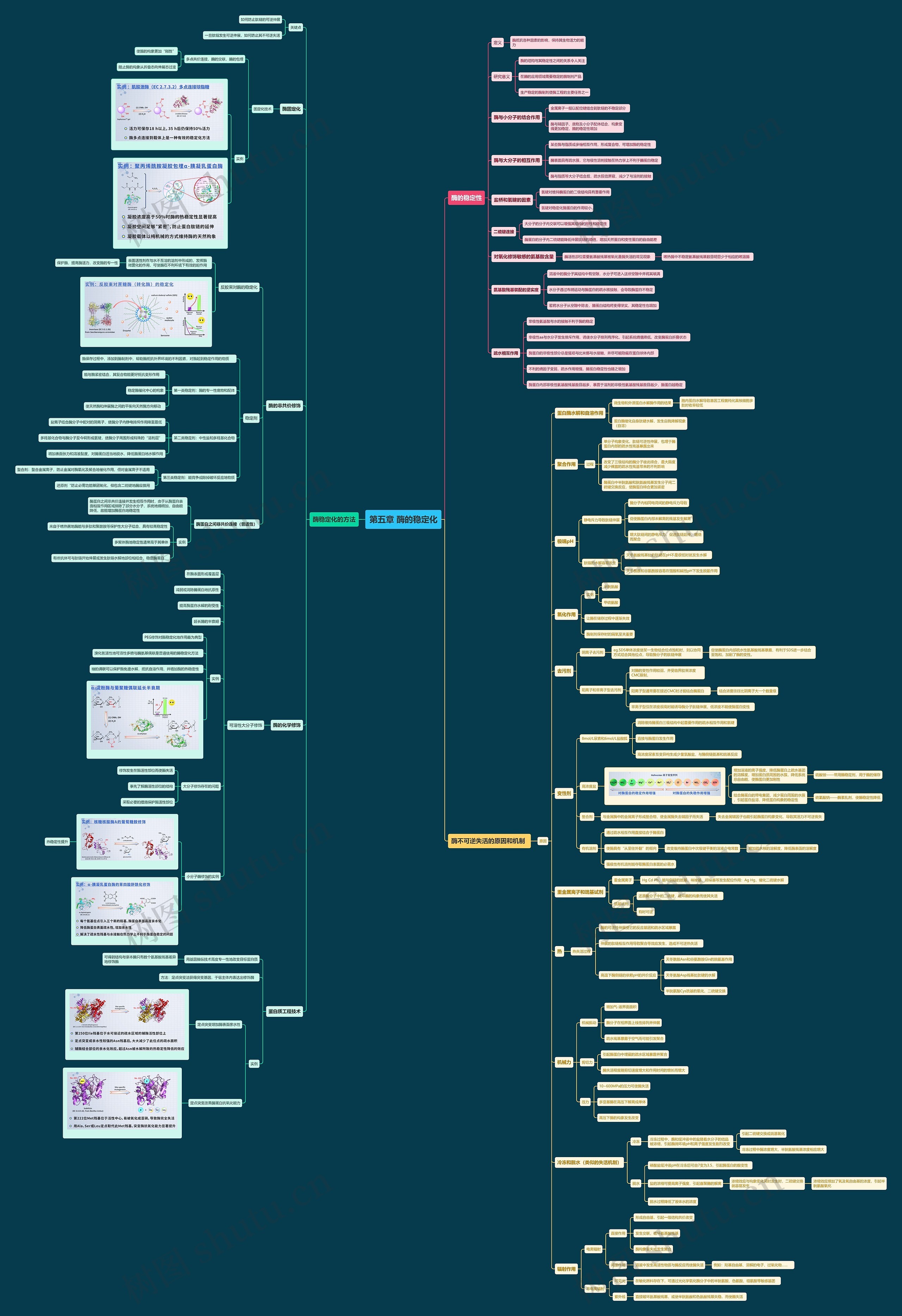
酶的稳定性
定义
酶抵抗各种因素的影响,保持其生物活力的能力
研究意义
酶的结构与其稳定性之间的关系令人关注
在酶的应用领域需要稳定的酶制剂产品
生产稳定的酶制剂使酶工程的主要任务之一
酶与小分子的结合作用
金属离子一般以配位键结合到肽链的不稳定部分
酶与辅因子、底物及小分子配体结合,构象变得更加稳定,酶的稳定性增加
酶与大分子的相互作用
某些酶与脂质或多糖相互作用,形成复合物,可增加酶的稳定性
酶表面具有疏水簇,它与极性溶剂接触在热力学上不利于酶蛋白稳定
酶与脂质等大分子结合后,疏水簇倍屏蔽,减少了与溶剂的接触
盐桥和氢键的因素
氢键对维持酶蛋白的二级结构具有重要作用
氢键对稳定化酶蛋白的作用较小
二硫键连接
大分子的分子内交联可以增强其结构的刚性和稳定性
酶蛋白的分子内二硫键能降低伸展肽链的熵值,增加天然蛋白和变性蛋白的自由能差
对氧化修饰敏感的氨基酸含量
酶活性部位重要氨基酸残基被氧化是酶失活的常见现象
嗜热酶中不稳定氨基酸残基数目明显少于相应的嗜温酶
氨基酸残基装配的坚实度
溶液中的酶分子其结构中有空隙,水分子可进入这些空隙中并将其填满
水分子通过布朗运动与酶蛋白的疏水核接触,会导致酶蛋白不稳定
若将水分子从空隙中除去,酶蛋白结构将变得坚实,其稳定性也增加
疏水相互作用
非极性氨基酸与水的接触不利于酶的稳定
非极性aa与水分子发生排斥作用,诱使水分子排列有序化,引起系统熵值降低,改变酶蛋白折叠状态
酶蛋白的非极性部分总是强项与比米娜与水接触,并尽可能隐藏在蛋白球体内部
不利的熵因子变弱,疏水作用增强,酶蛋白稳定性也随之增加
酶蛋白内部非极性氨基酸残基数目越多,暴露于溶剂的非极性氨基酸残基数目越少,酶蛋白越稳定
酶稳定化的方法
关键点
如何防止肽链的可逆伸展
一旦肽链发生可逆伸展,如何防止其不可逆失活
酶固定化
固定化技术
多点共价连接,酶的交联,酶的包埋
使酶的构象更加“刚性”
阻止酶的构象从折叠态向伸展态过渡
实例
酶的非共价修饰
反胶束对酶的稳定化
表面活性剂在与水不互溶的溶剂中形成的,发挥酶微囊化的作用,可使酶在不利环境下有效的起作用
保护酶,提高酶活力,改变酶的专一性
稳定剂
酶保存过程中,添加到酶制剂中,帮助酶抵抗外界环境的不利因素,对酶起到稳定作用的物质
第一类稳定剂:酶的专一性底物和配体
能与酶紧密结合,其复合物能更好抵抗变形作用
稳定酶催化中心的构象
使天然酶和伸展酶之间的平衡向天然酶方向移动
第二类稳定剂:中性盐和多羟基化合物
盐离子结合酶分子中配对的阴离子,使酶分子内静电排斥作用降至最低
多羟基化合物与酶分子至今啊形成氢键,使酶分子周围形成特殊的“溶剂层”
增加表面张力和溶液黏度,对酶蛋白适当地脱水,降低酶蛋白地水解作用
第三类稳定剂:能竞争或除掉破坏反应地物质
螯合剂:螯合金属离子,防止金属对酶氧化及聚合地催化作用,但对金属离子不适用
还原剂“防止必需功能基团氧化,但包含二硫键地酶应慎用
酶蛋白之间非共价连接(普适性)
酶蛋白之间非共价连接并发生相互作用时,由于从酶蛋白表面相互作用区域排除了部分水分子,系统地熵增加,自由能降低,故能增加酶蛋白地稳定性
实例
来自于嗜热菌地酶能与多肽和聚酰胺等保护性大分子结合,具有较高稳定性
多聚体酶地稳定性通常高于其单体
有些抗体可与肽链开始伸展或发生肽链水解地部位相结合,稳定酶蛋白
酶的化学修饰
可溶性大分子修饰
在酶表面形成覆盖层
减弱或消除酶蛋白地抗原性
提高酶蛋白水解的耐受性
延长酶的半衰期
实例
PEG修饰对酶稳定化地作用最为典型
溴化氢活性地可溶性多糖与酶氨基偶联是普遍使用的酶稳定化方法
糖的偶联可以保护酶免遭水解,抵抗自溶作用,并增加酶的热稳定性
大分子修饰存在的问题
修饰发生在酶活性部位而使酶失活
事先了解酶活性部位的结构
采取必要的措施保护酶活性部位
小分子酶修饰的实例
热稳定性提升
蛋白质工程技术
用基因操纵技术高度专一性地改变目标蛋白质
可得到结构与亲本酶只有数个氨基酸残基差异地修饰酶
方法:定点突变法获得突变基因,于宿主体内表达出修饰酶
实例
定点突变增加酶表面亲水性
定点突变改善酶蛋白抗氧化能力
酶不可逆失活的原因和机制
原因
蛋白酶水解和自溶作用
微生物和外源蛋白水解酶作用的结果
胞内蛋白水解导致基因工程菌纯化真核细胞多肽时收率较低
蛋白酶催化自身肽键水解,发生自我降解现象(自溶)
聚合作用
过程
单分子构象变化,肽链可逆性伸展,包埋于酶蛋白内部的疏水性残基暴露出来
改变了三级结构的酶分子彼此缔合,最大限度减少裸露的疏水性残基带来的不利影响
酶蛋白中半胱氨酸和胱氨酸残基发生分子间二硫键交换反应,使酶蛋白缔合更加紧密
极端pH
静电斥力导致肽链伸展
酶分子内相同电荷间的静电斥力导致
促使酶蛋白内部未解离的残基发生解离
增大肽链间的静电斥力,促进肽链延伸、缠绕而聚合
肽链的水解容易发生
天冬氨酸残基处的肽键在pH不是很低时就发生水解
天冬酰胺和谷氨酰胺容易在强酸和碱性pH下发生脱氨作用
氧化作用
实例
半胱氨酸
甲硫氨酸
让酶在储存过程中逐渐失效
酶制剂保存时的隔氧至关重要
去污剂
阴离子去污剂
eg.SDS单体浓度使某一生物结合位点饱和时,则以协同方式结合其他位点,导致酶分子的肽链伸展
促使酶蛋白内部疏水性氨基酸残基暴露,有利于SDS进一步结合至饱和,加剧了酶的变性。
阳离子和非离子型去污剂
对酶的变性作用较弱,并受临界胶束浓度CMC限制,
阳离子型通常要在接近CMC时才能结合酶蛋白
结合浓度往往比阴离子大一个数量级
非离子型仅在浓度很高时能诱导酶分子肽链伸展,低浓度不能使酶蛋白变性
变性剂
8mol/L尿素和6mol/L盐酸胍
消除维持酶蛋白三级结构中起重要作用的疏水相互作用和氢键
直接与酶蛋白发生作用
高浓度尿素互变异构生成少量氯酸盐,与酶侧链氨基和巯基反应
高浓度盐
增加溶液的离子强度,降低酶蛋白上疏水基团的溶解度,增加蛋白质周围的水簇,降低系统总自由能,使酶蛋白更加刚性
硫酸铵——常用酶稳定剂,用于酶的储存
结合酶蛋白的带电集团,减少蛋白周围的水簇,引起蛋白盐溶,降低蛋白构象的稳定性
硫氰酸钠——酶紊乱剂,使酶稳定性降低
螯合剂
与金属酶中的金属离子形成螯合物,使金属酶失去辅因子而失活
失去金属辅因子也能引起酶蛋白构象变化,导致其活力不可逆丧失
有机溶剂
通过疏水相互作用直接结合于酶蛋白
使酶具有“从里往外翻”的倾向
改变维持酶蛋白中次级键平衡的溶液介电常数
增加疏水核的溶解度,降低酶表面的溶解度
强极性有机溶剂能夺取酶蛋白表面的必需水
重金属离子和巯基试剂
重金属离子
Hg Cd Pb,能与侧链的巯基、咪唑基、吲哚基等发生配位作用:Ag Hg,催化二硫键水解
巯基试剂
还原酶分子中的二硫键,破坏酶的构象而使其失活
有时可逆
热
热失活过程
酶的可逆性伸展使它的反应基团和疏水区域暴露
伸展的肽链相互作用导致聚合等效应发生,造成不可逆热失活
高温下酶侧链的依赖pH的共价反应
天冬酰胺Asn和谷氨酰胺Gln的脱氨基作用
天冬氨酸Asp残基处肽键的水解
半胱氨酸Cys巯基的氧化、二硫键交换
机械力
机械振动
增加气-液界面面积
酶分子在相界面上线性排列并伸展
疏水残基暴露于空气而可能引发聚合
剪切力
引起酶蛋白中埋藏的疏水区域暴露并聚合
酶失活程度随剪切速度增大和作用时间的增长而增大
压力
10~600MPa的压力可使酶失活
多亚基酶在高压下解离成单体
高压下酶的构象发生改变
冷冻和脱水(类似的失活机制)
冷冻
冷冻过程中,酶和缓冲液中的盐随着水分子的结晶被浓缩,引起酶微环境pH和离子强度发生剧烈改变
引起二硫键交换或巯基氧化
冷冻过程中酶浓度增大,半胱氨酸残基浓度相应增大
脱水
磷酸盐缓冲液pH在冷冻后可由7变为3.5,引起酶蛋白的酸变性
盐的浓缩可提高离子强度,引起寡聚酶的解离
浓缩效应与构象变化同时发生时,二硫键交换就容易发生
浓缩效应增加了氧及氧自由基的浓度,引起半胱氨酸氧化
脱水过程降低了液体水的浓度
辐射作用
电离辐射
直接作用
形成自由基,引起一级结构共价改变
发生交联,破坏氨基酸残基
酶构象丧失或发生聚合
间接作用
溶液中发生高活性物质与酶反应而使酶失活
例如:羟基自由基、溶解的电子、过氧化物……
非电离辐射
可见光
在敏化燃料存在下,可通过光化学氧化酶分子中的半胱氨酸、色氨酸、组氨酸等敏感基团
紫外线
直接破坏氨基酸残基,或使半胱氨酸和色氨酸残基失稳,而使酶失活
相关思维导图模板


树图思维导图提供 904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查 在线思维导图免费制作,点击“编辑”按钮,可对 904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:10b9a8a2dd2fb4593f8130ef16c320fc

树图思维导图提供 9.战斗的基督教 在线思维导图免费制作,点击“编辑”按钮,可对 9.战斗的基督教 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:33d168acd0cd9f767f809c7a5df86e3a









 上海工商
上海工商