关于物质氧化性或还原性强弱判断的几点讨论思维导图

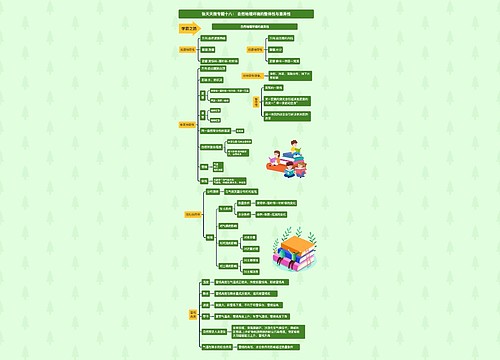
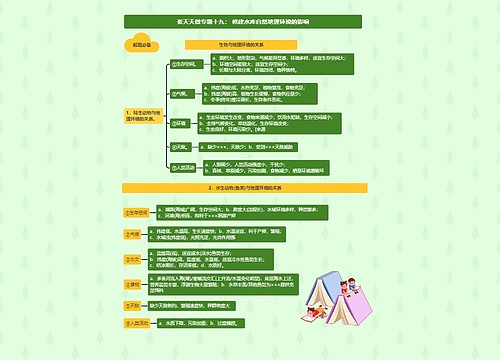
1、强弱规律:氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。诸位请注意,此规律是有应用条件的,即仅限于自发的氧化还原反应。
树图思维导图提供 关于物质氧化性或还原性强弱判断的几点讨论 在线思维导图免费制作,点击“编辑”按钮,可对 关于物质氧化性或还原性强弱判断的几点讨论 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:9e2f20ee2871185d8b182de8b7efe4cc
思维导图大纲
关于物质氧化性或还原性强弱判断的几点讨论思维导图模板大纲
1、强弱规律:氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。诸位请注意,此规律是有应用条件的,即仅限于自发的氧化还原反应。借此顺便提及,中学化学常见的氧化剂中,不时会见到关于O2和Cl2二者氧化性孰强孰弱的争执,有人依狄康法制Cl2,由"前强后弱"推出O2氧化性大于Cl2,忽视了反应条件及催化剂作用,而实际上我们也都知道,Cl2与H2O反应也能放出O2这一事实。
2、同一还原剂与不同氧化剂反应,被氧化的价态越高,则对应的氧化剂氧化性越强。此规律经几道近年高考题考察后,越发地成为教学和命题的热点。但请诸位注意,不是所有现象都可套用此规律。依然以O2与Cl2为例,二者分别与Fe反应,显然后者被氧化得"完全",而前者只能生成Fe3O4,于是得出结论,后者氧化性更强。结论没错,但请注意,Fe与纯O2反应只生成Fe3O4是因为高温下该氧化物稳定,而不是O2没能力将Fe完全氧化成+3价!
3、氧化性或还原性强弱须在相同条件下进行比较,条件或状态不同,强弱关系可能不同。如H2S与I2,溶液状态下二者反应,气态时反应情况刚好相反。由此顺便提及,教材教辅中依照金属活动序判断金属单质还原性强弱(或其阳离子氧化性强弱)是有一定局限的,活动序应用的前提必须是在水溶液中!Na置换K就是一例。
4、用反应速率来比较氧化性或还原性强弱是根本错误的!速率是动力学范畴,而强弱及反应趋势属热力学范畴,我们不能因为有人看到一个白色的小动物就说那一定是头猪。但是用反应速率可以讨论反应是否发生及进行是否完全(这一点在含氧阴离子上非常明显),比如Na和CuSO4的反应,Cu2+氧化性、数量均大于H+,但与Na反应速率慢导致被H+ "捷足先登",这是此反应不能置换出Cu的重要原因。
关于氧化剂、还原剂强弱判断,个人认为我们教师一定要知道很多,明确可否,但在实际教学中,不论是课改后模块教学要求也好还是具体操作层面,都没必要给学生总结太多的"规律",注重培养训练学生化学学习及解题中的强弱意识、"优先意识"才是重点。
相关思维导图模板

树图思维导图提供 904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查 在线思维导图免费制作,点击“编辑”按钮,可对 904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:10b9a8a2dd2fb4593f8130ef16c320fc
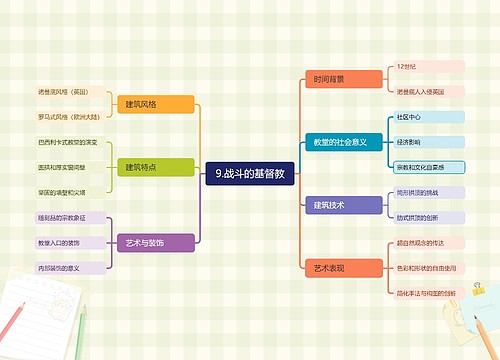

树图思维导图提供 9.战斗的基督教 在线思维导图免费制作,点击“编辑”按钮,可对 9.战斗的基督教 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:33d168acd0cd9f767f809c7a5df86e3a









 上海工商
上海工商