高一化学名师讲义教学教案:溶解度 教案(二)思维导图

溶液组成的表示方法教案(一)教学重点:有关溶液中溶质的质量分数的计算。教学难点:1.理解溶液组成的含义。
树图思维导图提供 高一化学名师讲义教学教案:溶解度 教案(二) 在线思维导图免费制作,点击“编辑”按钮,可对 高一化学名师讲义教学教案:溶解度 教案(二) 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:1edee1b7efc7645765672ce295d5f8da
思维导图大纲
高一化学名师讲义教学教案:溶解度 教案(二)思维导图模板大纲
溶液组成的表示方法 教案(一)
教学重点:
有关溶液中溶质的质量分数的计算。
教学难点:
1.理解溶液组成的含义。
2.溶质的质量分数的计算中,涉及溶液体积时的计算。
教学过程:
第一课时
(引言)
在日常生活中我们经常说某溶液是浓还是稀,但浓与稀是相对的,它不能说明溶液中所含溶质的确切量,因此有必要对溶液的浓与稀的程度给以数量的意义。
(板书) 第五节 溶液组成的表示方法
一、溶液组成的表示方法
(设问)在溶液中,溶质、溶剂或溶液的量如果发生变化,那么对溶液的浓稀会有什么影响?
(讲述)表示溶液组成的方法很多,本节重点介绍溶质质量分数。
(板书)1.溶质的质量分数
定义:溶质的质量分数是溶质质量与溶液质量之比。
2.溶质的质量分数的数学表达式:
溶质的质量分数=溶质的质量¸溶液的质量
(提问)某食盐水的溶质的质量分数为16%,它表示什么含义?
(讲述)这表示在100份质量的食盐溶液中,有16份质量的食盐和84份质量的水。
(板书)二 一定溶质的质量分数的溶液的配制。
例:要配制20%的NaOH溶液300克,需NaOH和水各多少克? 溶解度 教案(三)
一、教学目标
1.理解固体物质溶解度的概念。了解溶解度和溶解性的区别和联系。
2.进一步练习给试管里的液体加热、向试管里滴加液体和振荡试管的操作;培养学生设计简单实验步骤的能力。
3.从影响溶解度的诸因素中,对学生进行内因和外因的辩证唯物主义教育。
二、教学方法
边讲边实验。
相关思维导图模板
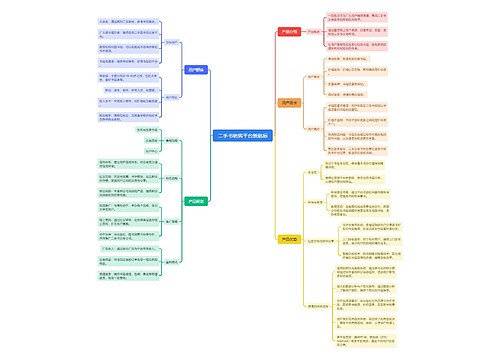

树图思维导图提供 二手书销售平台新航标 在线思维导图免费制作,点击“编辑”按钮,可对 二手书销售平台新航标 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:a92403b70afada50cf4fa4f56e0981c9
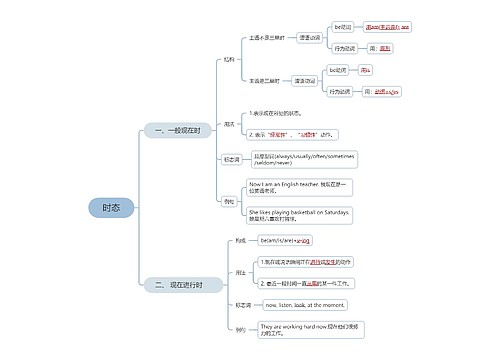

树图思维导图提供 时态介绍 在线思维导图免费制作,点击“编辑”按钮,可对 时态介绍 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:2afd76910294d6f355939784d170f8db















 上海工商
上海工商