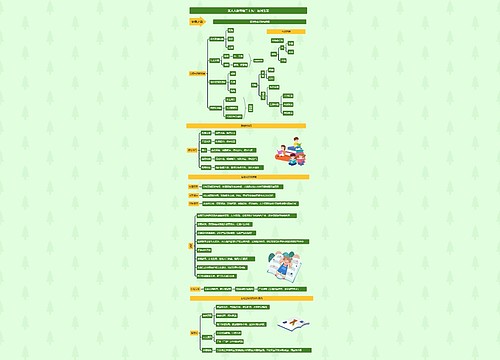
高二化学复习要点:单质与硝酸反应的计算思维导图
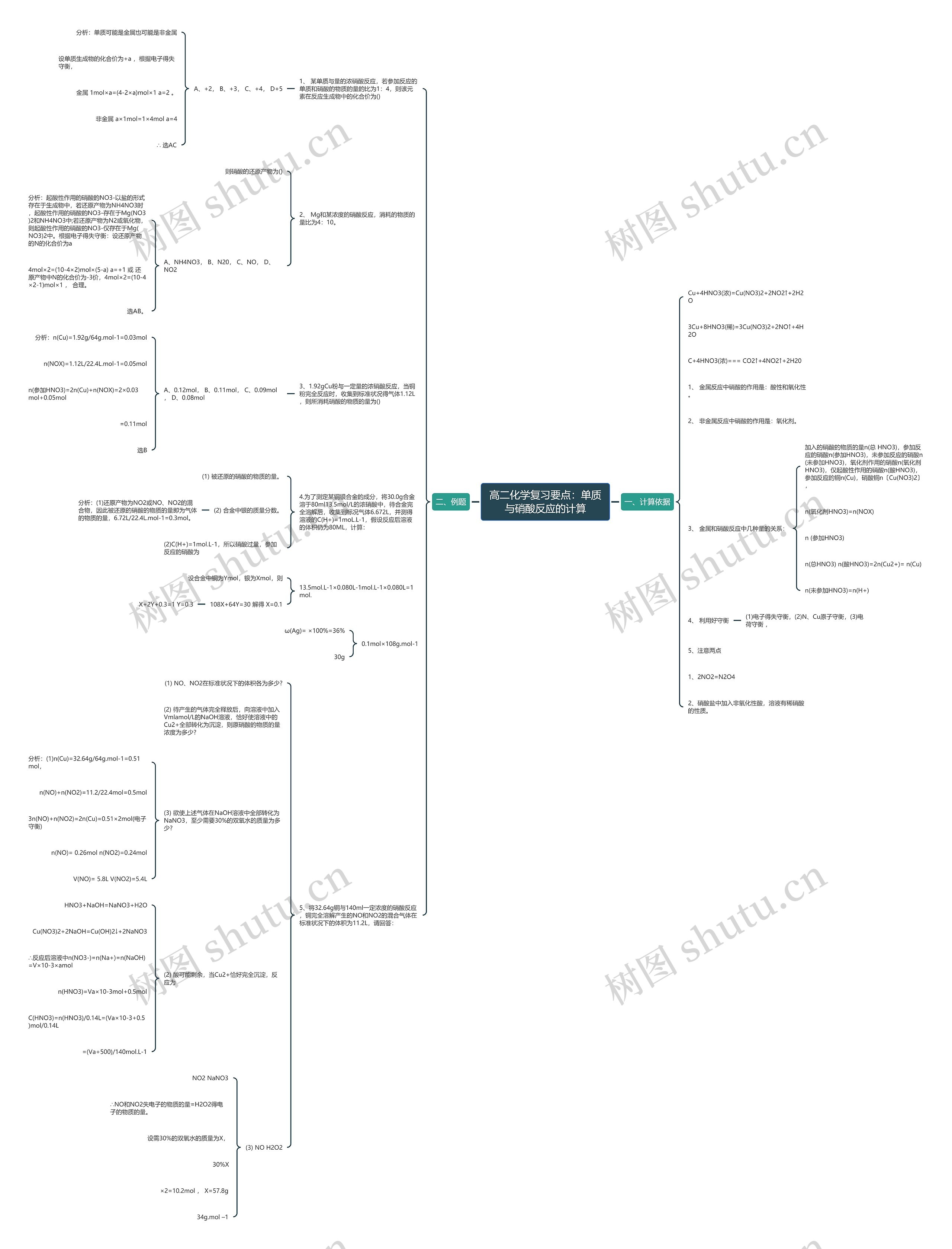
一、计算依据Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2OC+4HNO3(浓)=== CO2↑+4NO2↑+2H20
树图思维导图提供 高二化学复习要点:单质与硝酸反应的计算 在线思维导图免费制作,点击“编辑”按钮,可对 高二化学复习要点:单质与硝酸反应的计算 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:489d495be58f2ea36d4cf4f5095a86e3
思维导图大纲
高二化学复习要点:单质与硝酸反应的计算思维导图模板大纲
一、计算依据
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
C+4HNO3(浓)=== CO2↑+4NO2↑+2H20
1、 金属反应中硝酸的作用是:酸性和氧化性。
2、 非金属反应中硝酸的作用是:氧化剂。
3、 金属和硝酸反应中几种量的关系:
加入的硝酸的物质的量n(总 HNO3),参加反应的硝酸n(参加HNO3),未参加反应的硝酸n(未参加HNO3),氧化剂作用的硝酸n(氧化剂HNO3),仅起酸性作用的硝酸n(酸HNO3),参加反应的铜n(Cu),硝酸铜n〔Cu(NO3)2〕,
n(氧化剂HNO3)=n(NOX)
n (参加HNO3)
n(总HNO3) n(酸HNO3)=2n(Cu2+)= n(Cu)
n(未参加HNO3)=n(H+)
4、 利用好守衡
(1)电子得失守衡,(2)N、Cu原子守衡,(3)电荷守衡 ,
5、注意两点
1、2NO2=N2O4
2、硝酸盐中加入非氧化性酸,溶液有稀硝酸的性质。
二、例题
1、 某单质与量的浓硝酸反应,若参加反应的单质和硝酸的物质的量的比为1:4,则该元素在反应生成物中的化合价为()
A、+2, B、+3, C、+4, D+5
分析:单质可能是金属也可能是非金属
设单质生成物的化合价为+a ,根据电子得失守衡,
金属 1mol×a=(4-2×a)mol×1 a=2 。
非金属 a×1mol=1×4mol a=4
∴ 选AC
2、 Mg和某浓度的硝酸反应,消耗的物质的量比为4:10。
则硝酸的还原产物为()
A、NH4NO3, B、N20, C、NO, D、NO2
分析:起酸性作用的硝酸的NO3-以盐的形式存在于生成物中,若还原产物为NH4NO3时,起酸性作用的硝酸的NO3-存在于Mg(NO3)2和NH4NO3中;若还原产物为N2或氧化物,则起酸性作用的硝酸的NO3-仅存在于Mg(NO3)2中。根据电子得失守衡:设还原产物的N的化合价为a
4mol×2=(10-4×2)mol×(5-a) a=+1 或 还原产物中N的化合价为-3价,4mol×2=(10-4×2-1)mol×1 , 合理。
选AB。
3、1.92gCu粉与一定量的浓硝酸反应,当铜粉完全反应时,收集到标准状况得气体1.12L,则所消耗硝酸的物质的量为()
A、0.12mol, B、0.11mol, C、0.09mol , D、0.08mol
分析:n(Cu)=1.92g/64g.mol-1=0.03mol
n(NOX)=1.12L/22.4L.mol-1=0.05mol
n(参加HNO3)=2n(Cu)+n(NOX)=2×0.03mol+0.05mol
=0.11mol
选B
4.为了测定某铜银合金的成分,将30.0g合金溶于80ml13.5mol/L的浓硝酸中,待合金完全溶解后,收集到标况气体6.672L,并测得溶液的C(H+)=1moL.L-1,假设反应后溶液的体积仍为80ML,计算:
(1) 被还原的硝酸的物质的量。
(2) 合金中银的质量分数。
分析:(1)还原产物为NO2或NO、NO2的混合物,因此被还原的硝酸的物质的量即为气体的物质的量,6.72L/22.4L.mol-1=0.3mol。
(2)C(H+)=1mol.L-1,所以硝酸过量,参加反应的硝酸为
13.5mol.L-1×0.080L-1mol.L-1×0.080L=1mol.
设合金中铜为Ymol,银为Xmol,则
108X+64Y=30 解得 X=0.1
X+2Y+0.3=1 Y=0.3
0.1mol×108g.mol-1
ω(Ag)= ×100%=36%
30g
5、将32.64g铜与140ml一定浓度的硝酸反应,铜完全溶解产生的NO和NO2的混合气体在标准状况下的体积为11.2L,请回答:
(1) NO、NO2在标准状况下的体积各为多少?
(2) 待产生的气体完全释放后,向溶液中加入Vmlamol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化为沉淀,则原硝酸的物质的量浓度为多少?
(3) 欲使上述气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水的质量为多少?
分析:(1)n(Cu)=32.64g/64g.mol-1=0.51mol,
n(NO)+n(NO2)=11.2/22.4mol=0.5mol
3n(NO)+n(NO2)=2n(Cu)=0.51×2mol(电子守衡)
n(NO)= 0.26mol n(NO2)=0.24mol
V(NO)= 5.8L V(NO2)=5.4L
(2) 酸可能剩余,当Cu2+恰好完全沉淀,反应为
HNO3+NaOH=NaNO3+H2O
Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3
∴反应后溶液中n(NO3-)=n(Na+)=n(NaOH)=V×10-3×amol
n(HNO3)=Va×10-3mol+0.5mol
C(HNO3)=n(HNO3)/0.14L=(Va×10-3+0.5)mol/0.14L
=(Va+500)/140mol.L-1
(3) NO H2O2
NO2 NaNO3
∴NO和NO2失电子的物质的量=H2O2得电子的物质的量。
设需30%的双氧水的质量为X,
30%X
×2=10.2mol , X=57.8g
34g.mol –1
相关思维导图模板


树图思维导图提供 904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查 在线思维导图免费制作,点击“编辑”按钮,可对 904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:10b9a8a2dd2fb4593f8130ef16c320fc

树图思维导图提供 9.战斗的基督教 在线思维导图免费制作,点击“编辑”按钮,可对 9.战斗的基督教 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:33d168acd0cd9f767f809c7a5df86e3a










 上海工商
上海工商