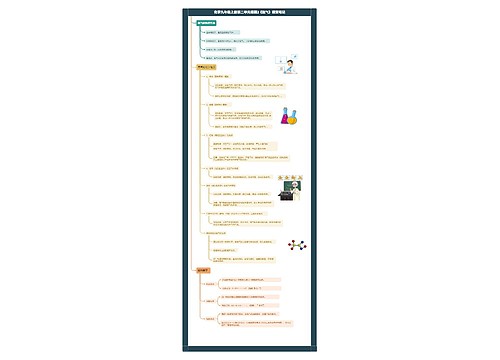
高二化学备考:元素周期表2思维导图

树图网汇集整理《高二化学备考:元素周期表2》,以及最全的高考备考资料,有语文、数学、英语、物理、化学、生物、政治、历史、地理、文综、理综复习学习资料,复习讲义、听力材料、作文素材,历年真题试题下载及答案解析,完备的资料库为广大考生提供全面的备考参考。
树图思维导图提供 高二化学备考:元素周期表2 在线思维导图免费制作,点击“编辑”按钮,可对 高二化学备考:元素周期表2 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:02b894ac524d36f1aa2bd81d1ec7314d
思维导图大纲
高二化学备考:元素周期表2思维导图模板大纲
教学目标
1.使学生理解同周期、同主族元素性质的递变规律,并能运用原子结构理论解释这些递变规律。
2.使学生了解原子结构、元素性质及该元素在周期表中的位置三者之间的关系,初步学会运用周期表。
教学重点 元素的性质、元素在周期表中的位置与原子结构的关系
教学难点 元素的性质、元素在周期表中的位置和原子结构的关系
教学方法 启发、诱导、阅读、讨论、练习、探究等
教学用具 投影仪、胶片、元素周期表挂图
教学过程
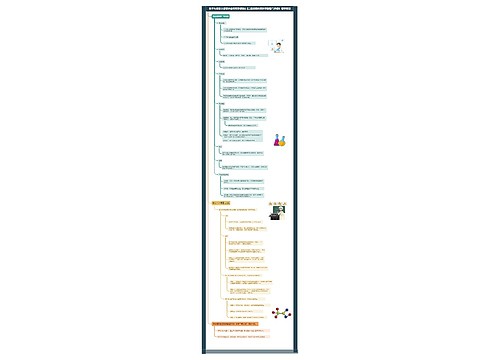
[引言]上节课我们认识了元素周期表的结构,那么,我们如何根据元素周期表中各元素所在位置来认识各元素的性质,从而使我们更好地认识自然,并指导我们的社会实践呢?这就是我们本节课所要讲的主要内容。
[板书] 第三节 元素周期表(第二课时)
二、元素的性质与元素在周期表中位置的关系
[师]我们知道,元素在周期表中的位置,由元素原子的结构决定,而元素原子的结构又决定了元素的性质,即元素的性质是元素在元素周期表中的位置的外在反映。因此,可以根据某元素在周期表中的位置,推测它的原子结构和某些性质;同样,也可以根据元素的原子结构,推测它在周期表中的位置。下面,我们就从元素的金属性和非金属性、元素的化合价两方面来研究元素的性质与元素在周期表中位置的关系。(中学化学里我们主要研究主族元素)
[板书] 1.元素的金属性和非金属性与元素在周期表中位置的关系:
[师]请大家根据前面所学元素周期律的知识,回答下列问题:
[投影练习]
(1)电子层数越多—→原子半径越 大 —→核对电子引力越 弱 —→原子失电子能力越 强 —→得电子能力越 弱 —→金属性越 强 —→非金属性越 弱 。
(2)电子层数相同,质子数越多(即原子序数越大) —→原子半径越 小 —→核对电子的引力越 强 —→原子失电子能力越 弱 —→得电子能力越 强 —→金属性越 弱 —→非金属性越 强 。
(3)元素周期表中:周期序数 = 电子层数 ;主族序数= 最外层电子数 ;原子序数= 核内质子数 ;
[师]请大家看下列元素的原子结构示意图。
[投影] [问]在元素周期表中,它们是否属于同一主族?为什么?
不是。因为它们的最外层电子数不同。
[问]它们是否属于同一周期?为什么? 是。因为它们的电子层数相同。
[问]它们是第几周期的元素? 第三周期
[师]请大家分析它们的原子结构,判断其金属性与非金属性的强弱。
上述同一周期、不同主族的元素,元素原子核外电子层数虽然相同,但从左到右核电荷数依次增多,原子半径逐渐减少,失电子能力逐渐减弱,得电子能力逐渐增强。因此,金属性逐渐减弱,非金属性逐渐增强。
[师]由此,我们可得出如下结论:
[板书](1)同一周期,从左至右,各元素的金属性逐渐减弱,非金属性逐渐增强。(稀有气体元素除外)
[师]请大家口头判断下列各问题:
[师]上述三组元素分别属于同一周期还是同一主族?依据?分别属于第几周期(或主族)?
同一主族。因为它们最外层电子数相同。分别属于第一主族,第五主族和第七主族。
[师]1、3组元素有无似曾相识之感?请分别写出它们的元素符号。
[师]请大家根据其原子结构分析其金属性的递变规律。
在同一主族的元素中,由于从上到下电子层数依次增多,原子半径逐渐增大,失电子能力逐渐增强,得电子能力逐渐减弱。所以元素的金属性逐渐增强,非金属性逐渐减弱。
[师]由此,我们可以得出以下结论:
[板书](2)同一主族,从上到下元素金属性逐渐增强,非金属性逐渐减弱。
[师]口答以下练习
[投影]
[问]元素周期表中的表格底色有几种?为什么要这样表示?
底色有两种,绿色和浅绿色。可以使我们很明显地区别出金属元素和非金属元素。
[师]而且,从表上我们可以看出,元素周期表中,金属元素和非金属元素的区域特别集中,沿着周期表中硼、硅、砷,碲、砹跟铝、锗、锑、钋之间画一条线,线的左面是金属元素,右面是非金属元素。由于元素的金属性和非金属性之间没有严格的界线,因此,位于分界线附近的元素,既能表现出一定的金属性,又能表现出一定的非金属性。
[师]我们可以把以上的内容用表5—12的形式简要地表示出来
[投影]
[师]请大家根据我们上面学过的知识,参考元素周期表,分析除稀有气体元素外,在周期表中什么元素的金属性最强?什么元素的非金属性最强?为什么?
根据同周期同主族原子半径的变化规律可知,在周期表中,钫(Fr)元素的原子半径最大,氟(F)元素的原子半径最小,因此,钫元素的失电子能力应是最强的,钫元素的金属性也就最强,氟元素的得电子能力最强,氟元素的非金属性也就最强。
[师]氟元素也是自然界中存在的非金属性最强的元素,钫及其后面的元素均是放射性元素,在自然界稳定存在的元素当中,铯(Cs)的金属性是最强的。
[投影练习]
下列性质的递变中,正确的是………………………………………………………( AB )
相关思维导图模板


树图思维导图提供 卫生化学--元素和无机物分析 在线思维导图免费制作,点击“编辑”按钮,可对 卫生化学--元素和无机物分析 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:4c942d0350c858e06a1f7ed29a86d096
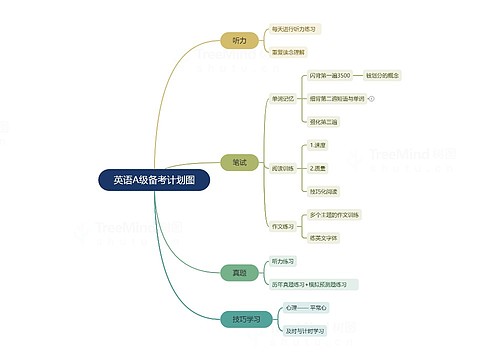

树图思维导图提供 英语A级备考计划图 在线思维导图免费制作,点击“编辑”按钮,可对 英语A级备考计划图 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:b3f78b99f422dcedde358446433905d4








 上海工商
上海工商