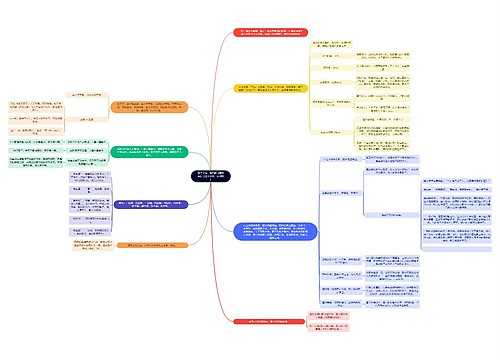
第1章 热力学第一定律思维导图
第1章 热力学第一定律
树图思维导图提供 第1章 热力学第一定律 在线思维导图免费制作,点击“编辑”按钮,可对 第1章 热力学第一定律 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:01fa24c8dd19c276ad78012f47727aa7
思维导图大纲
第1章 热力学第一定律思维导图模板大纲
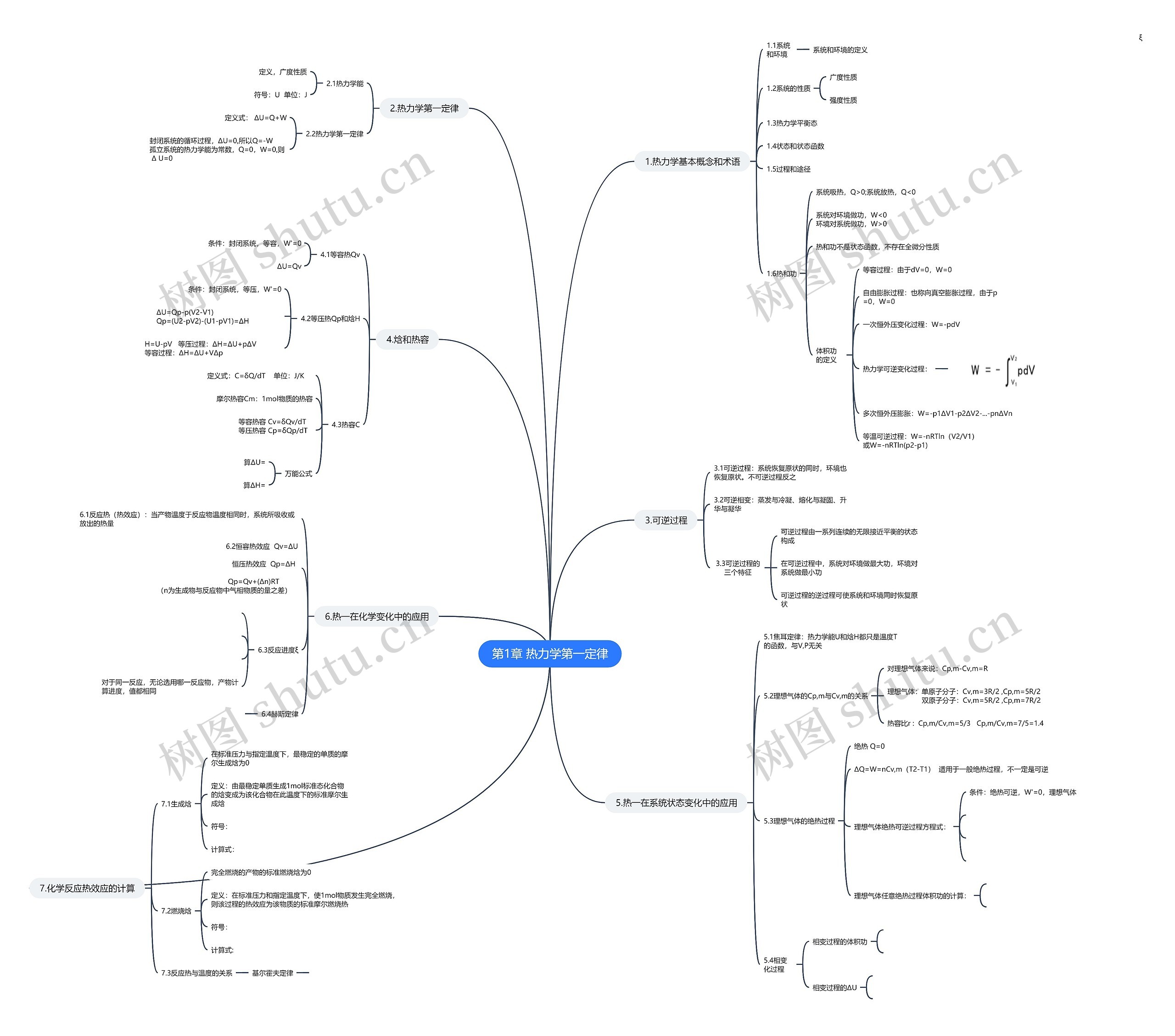
1.热力学基本概念和术语
1.1系统和环境
系统和环境的定义
1.2系统的性质
广度性质
强度性质
1.3热力学平衡态
1.4状态和状态函数
1.5过程和途径
1.6热和功
系统吸热,Q>0;系统放热,Q<0
系统对环境做功,W<0 环境对系统做功,W>0
热和功不是状态函数,不存在全微分性质
体积功的定义
等容过程:由于dV=0,W=0
自由膨胀过程:也称向真空膨胀过程,由于p=0,W=0
一次恒外压变化过程:W=-pdV
热力学可逆变化过程:
多次恒外压膨胀:W=-p1ΔV1-p2ΔV2-...-pnΔVn
等温可逆过程:W=-nRTln(V2/V1) 或W=-nRTln(p2-p1)
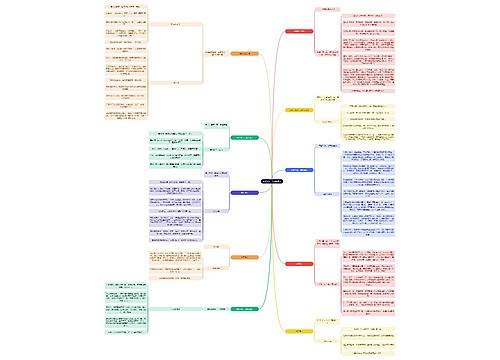
2.热力学第一定律
2.1热力学能
定义,广度性质
符号:U 单位:J
2.2热力学第一定律
定义式: ΔU=Q+W
封闭系统的循环过程,ΔU=0,所以Q=-W 孤立系统的热力学能为常数,Q=0,W=0,则 Δ U=0
3.可逆过程
3.1可逆过程:系统恢复原状的同时,环境也恢复原状。不可逆过程反之
3.2可逆相变:蒸发与冷凝、熔化与凝固、升华与凝华
3.3可逆过程的三个特征
可逆过程由一系列连续的无限接近平衡的状态构成
在可逆过程中,系统对环境做最大功,环境对系统做最小功
可逆过程的逆过程可使系统和环境同时恢复原状
4.焓和热容
4.1等容热Qv
条件:封闭系统,等容,W'=0
ΔU=Qv
4.2等压热Qp和焓H
条件:封闭系统,等压,W'=0
ΔU=Qp-p(V2-V1) Qp=(U2-pV2)-(U1-pV1)=ΔH
H=U-pV 等压过程:ΔH=ΔU+pΔV 等容过程:ΔH=ΔU+VΔp
4.3热容C
定义式:C=δQ/dT 单位:J/K
摩尔热容Cm:1mol物质的热容
等容热容 Cv=δQv/dT等压热容 Cp=δQp/dT
万能公式
算ΔU=
算ΔH=
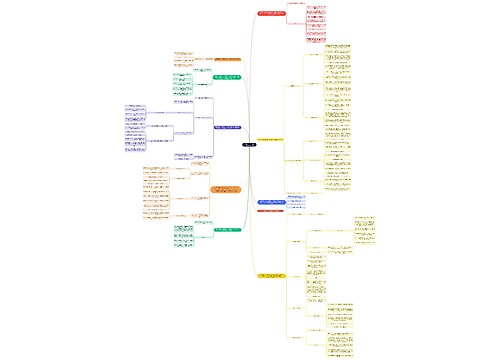
5.热一在系统状态变化中的应用
5.1焦耳定律:热力学能U和焓H都只是温度T的函数,与V,P无关
5.2理想气体的Cp,m与Cv,m的关系
对理想气体来说:Cp,m-Cv,m=R
理想气体:单原子分子:Cv,m=3R/2 ,Cp,m=5R/2 双原子分子:Cv,m=5R/2 ,Cp,m=7R/2
热容比r : Cp,m/Cv,m=5/3 Cp,m/Cv,m=7/5=1.4
5.3理想气体的绝热过程
绝热 Q=0
ΔQ=W=nCv,m(T2-T1) 适用于一般绝热过程,不一定是可逆
理想气体绝热可逆过程方程式:
条件:绝热可逆,W'=0,理想气体
理想气体任意绝热过程体积功的计算:
5.4相变化过程
相变过程的体积功
相变过程的ΔU
6.热一在化学变化中的应用
6.1反应热(热效应):当产物温度于反应物温度相同时,系统所吸收或放出的热量
6.2恒容热效应 Qv=ΔU 恒压热效应 Qp=ΔH Qp=Qv+(Δn)RT (n为生成物与反应物中气相物质的量之差)
6.3反应进度ξ
对于同一反应,无论选用哪一反应物,产物计算进度,值都相同
6.4赫斯定律
7.化学反应热效应的计算
7.1生成焓
在标准压力与指定温度下,最稳定的单质的摩尔生成焓为0
定义:由最稳定单质生成1mol标准态化合物的焓变成为该化合物在此温度下的标准摩尔生成焓
符号:
计算式:
7.2燃烧焓
完全燃烧的产物的标准燃烧焓为0
定义:在标准压力和指定温度下,使1mol物质发生完全燃烧,则该过程的热效应为该物质的标准摩尔燃烧热
符号:
计算式:
7.3反应热与温度的关系
基尔霍夫定律
ξ思维导图模板大纲
相关思维导图模板

树图思维导图提供 第六章 群体传播与组织传播_副本 在线思维导图免费制作,点击“编辑”按钮,可对 第六章 群体传播与组织传播_副本 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:1672f555831e7d9a3bb2cf2fb792cb49

树图思维导图提供 第1章 化工设计基本知识 在线思维导图免费制作,点击“编辑”按钮,可对 第1章 化工设计基本知识 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:70ec0519ed26419068a32a511862aadd









 上海工商
上海工商