高二化学必修三知识点梳理思维导图
高二本身的知识体系而言,它主要是对高一知识的深入和新知识模块的补充。以数学为例,除去不同学校教学进度的不同,我们会在高二接触到更为深入的函数,也将开始学习从未接触过的复数、圆锥曲线等题型。树图网高二频道为你整理了《高二化学必修三知识点梳理》希望对你有所帮助!
树图思维导图提供 高二化学必修三知识点梳理 在线思维导图免费制作,点击“编辑”按钮,可对 高二化学必修三知识点梳理 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:53338384278f0c963b19b4ec7599b44d
思维导图大纲
高二化学必修三知识点梳理思维导图模板大纲
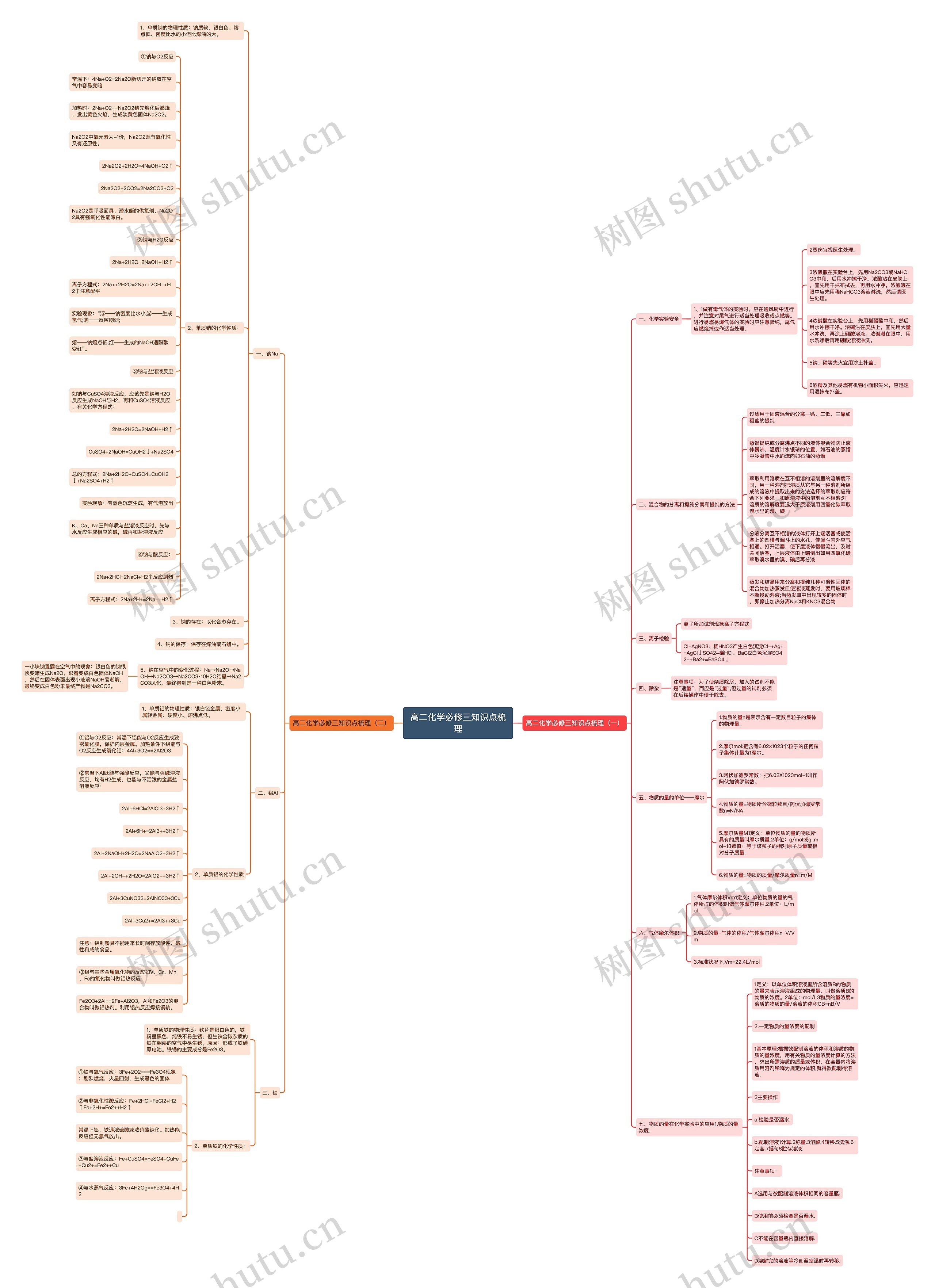
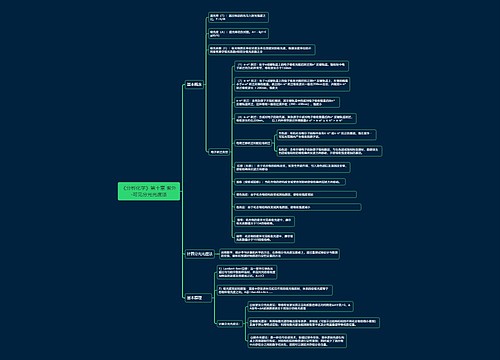
高二化学必修三知识点梳理(一)
一、化学实验安全
1、1做有毒气体的实验时,应在通风厨中进行,并注意对尾气进行适当处理吸收或点燃等。进行易燃易爆气体的实验时应注意验纯,尾气应燃烧掉或作适当处理。
2烫伤宜找医生处理。
3浓酸撒在实验台上,先用Na2CO3或NaHCO3中和,后用水冲擦干净。浓酸沾在皮肤上,宜先用干抹布拭去,再用水冲净。浓酸溅在眼中应先用稀NaHCO3溶液淋洗,然后请医生处理。
4浓碱撒在实验台上,先用稀醋酸中和,然后用水冲擦干净。浓碱沾在皮肤上,宜先用大量水冲洗,再涂上硼酸溶液。浓碱溅在眼中,用水洗净后再用硼酸溶液淋洗。
5钠、磷等失火宜用沙土扑盖。
6酒精及其他易燃有机物小面积失火,应迅速用湿抹布扑盖。
二、混合物的分离和提纯分离和提纯的方法
过滤用于固液混合的分离一贴、二低、三靠如粗盐的提纯
蒸馏提纯或分离沸点不同的液体混合物防止液体暴沸,温度计水银球的位置,如石油的蒸馏中冷凝管中水的流向如石油的蒸馏
萃取利用溶质在互不相溶的溶剂里的溶解度不同,用一种溶剂把溶质从它与另一种溶剂所组成的溶液中提取出来的方法选择的萃取剂应符合下列要求:和原溶液中的溶剂互不相溶;对溶质的溶解度要远大于原溶剂用四氯化碳萃取溴水里的溴、碘
分液分离互不相溶的液体打开上端活塞或使活塞上的凹槽与漏斗上的水孔,使漏斗内外空气相通。打开活塞,使下层液体慢慢流出,及时关闭活塞,上层液体由上端倒出如用四氯化碳萃取溴水里的溴、碘后再分液
蒸发和结晶用来分离和提纯几种可溶性固体的混合物加热蒸发皿使溶液蒸发时,要用玻璃棒不断搅动溶液;当蒸发皿中出现较多的固体时,即停止加热分离NaCl和KNO3混合物
三、离子检验
离子所加试剂现象离子方程式
Cl-AgNO3、稀HNO3产生白色沉淀Cl-+Ag+=AgCl↓SO42-稀HCl、BaCl2白色沉淀SO42-+Ba2+=BaSO4↓
四、除杂
注意事项:为了使杂质除尽,加入的试剂不能是“适量”,而应是“过量”;但过量的试剂必须在后续操作中便于除去。
五、物质的量的单位――摩尔
1.物质的量n是表示含有一定数目粒子的集体的物理量。
2.摩尔mol:把含有6.02×1023个粒子的任何粒子集体计量为1摩尔。
3.阿伏加德罗常数:把6.02X1023mol-1叫作阿伏加德罗常数。
4.物质的量=物质所含微粒数目/阿伏加德罗常数n=N/NA
5.摩尔质量M1定义:单位物质的量的物质所具有的质量叫摩尔质量.2单位:g/mol或g..mol-13数值:等于该粒子的相对原子质量或相对分子质量.
6.物质的量=物质的质量/摩尔质量n=m/M
六、气体摩尔体积
1.气体摩尔体积Vm1定义:单位物质的量的气体所占的体积叫做气体摩尔体积.2单位:L/mol
2.物质的量=气体的体积/气体摩尔体积n=V/Vm
3.标准状况下,Vm=22.4L/mol
七、物质的量在化学实验中的应用1.物质的量浓度.
1定义:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的浓度。2单位:mol/L3物质的量浓度=溶质的物质的量/溶液的体积CB=nB/V
2.一定物质的量浓度的配制
1基本原理:根据欲配制溶液的体积和溶质的物质的量浓度,用有关物质的量浓度计算的方法,求出所需溶质的质量或体积,在容器内将溶质用溶剂稀释为规定的体积,就得欲配制得溶液.
2主要操作
a.检验是否漏水.
b.配制溶液1计算.2称量.3溶解.4转移.5洗涤.6定容.7摇匀8贮存溶液.
注意事项:
A选用与欲配制溶液体积相同的容量瓶.
B使用前必须检查是否漏水.
C不能在容量瓶内直接溶解.
D溶解完的溶液等冷却至室温时再转移.
高二化学必修三知识点梳理(二)
一、钠Na
1、单质钠的物理性质:钠质软、银白色、熔点低、密度比水的小但比煤油的大。
2、单质钠的化学性质:
①钠与O2反应
常温下:4Na+O2=2Na2O新切开的钠放在空气中容易变暗
加热时:2Na+O2==Na2O2钠先熔化后燃烧,发出黄色火焰,生成淡黄色固体Na2O2。
Na2O2中氧元素为-1价,Na2O2既有氧化性又有还原性。
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2CO2=2Na2CO3+O2
Na2O2是呼吸面具、潜水艇的供氧剂,Na2O2具有强氧化性能漂白。
②钠与H2O反应
2Na+2H2O=2NaOH+H2↑
离子方程式:2Na++2H2O=2Na++2OH-+H2↑注意配平
实验现象:“浮——钠密度比水小;游——生成氢气;响——反应剧烈;
熔——钠熔点低;红——生成的NaOH遇酚酞变红”。
③钠与盐溶液反应
如钠与CuSO4溶液反应,应该先是钠与H2O反应生成NaOH与H2,再和CuSO4溶液反应,有关化学方程式:
2Na+2H2O=2NaOH+H2↑
CuSO4+2NaOH=CuOH2↓+Na2SO4
总的方程式:2Na+2H2O+CuSO4=CuOH2↓+Na2SO4+H2↑
实验现象:有蓝色沉淀生成,有气泡放出
K、Ca、Na三种单质与盐溶液反应时,先与水反应生成相应的碱,碱再和盐溶液反应
④钠与酸反应:
2Na+2HCl=2NaCl+H2↑反应剧烈
离子方程式:2Na+2H+=2Na++H2↑
3、钠的存在:以化合态存在。
4、钠的保存:保存在煤油或石蜡中。
5、钠在空气中的变化过程:Na→Na2O→NaOH→Na2CO3→Na2CO3·10H2O结晶→Na2CO3风化,最终得到是一种白色粉末。
一小块钠置露在空气中的现象:银白色的钠很快变暗生成Na2O,跟着变成白色固体NaOH,然后在固体表面出现小液滴NaOH易潮解,最终变成白色粉未最终产物是Na2CO3。
二、铝Al
1、单质铝的物理性质:银白色金属、密度小属轻金属、硬度小、熔沸点低。
2、单质铝的化学性质
①铝与O2反应:常温下铝能与O2反应生成致密氧化膜,保护内层金属。加热条件下铝能与O2反应生成氧化铝:4Al+3O2==2Al2O3
②常温下Al既能与强酸反应,又能与强碱溶液反应,均有H2生成,也能与不活泼的金属盐溶液反应:
2Al+6HCl=2AlCl3+3H2↑
2Al+6H+=2Al3++3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+3CuNO32=2AlNO33+3Cu
2Al+3Cu2+=2Al3++3Cu
注意:铝制餐具不能用来长时间存放酸性、碱性和咸的食品。
③铝与某些金属氧化物的反应如V、Cr、Mn、Fe的氧化物叫做铝热反应
Fe2O3+2Al==2Fe+Al2O3,Al和Fe2O3的混合物叫做铝热剂。利用铝热反应焊接钢轨。
三、铁
1、单质铁的物理性质:铁片是银白色的,铁粉呈黑色,纯铁不易生锈,但生铁含碳杂质的铁在潮湿的空气中易生锈。原因:形成了铁碳原电池。铁锈的主要成分是Fe2O3。
2、单质铁的化学性质:
①铁与氧气反应:3Fe+2O2===Fe3O4现象:剧烈燃烧,火星四射,生成黑色的固体
②与非氧化性酸反应:Fe+2HCl=FeCl2+H2↑Fe+2H+=Fe2++H2↑
常温下铝、铁遇浓硫酸或浓硝酸钝化。加热能反应但无氢气放出。
③与盐溶液反应:Fe+CuSO4=FeSO4+CuFe+Cu2+=Fe2++Cu
④与水蒸气反应:3Fe+4H2Og==Fe3O4+4H2
相关思维导图模板


树图思维导图提供 卫生化学--元素和无机物分析 在线思维导图免费制作,点击“编辑”按钮,可对 卫生化学--元素和无机物分析 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:4c942d0350c858e06a1f7ed29a86d096

树图思维导图提供 人教版必修一:分子与细胞 在线思维导图免费制作,点击“编辑”按钮,可对 人教版必修一:分子与细胞 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:38b99f99a660f9eb846aafd51549cc03








 上海工商
上海工商