人教版高二化学知识点整理思维导图
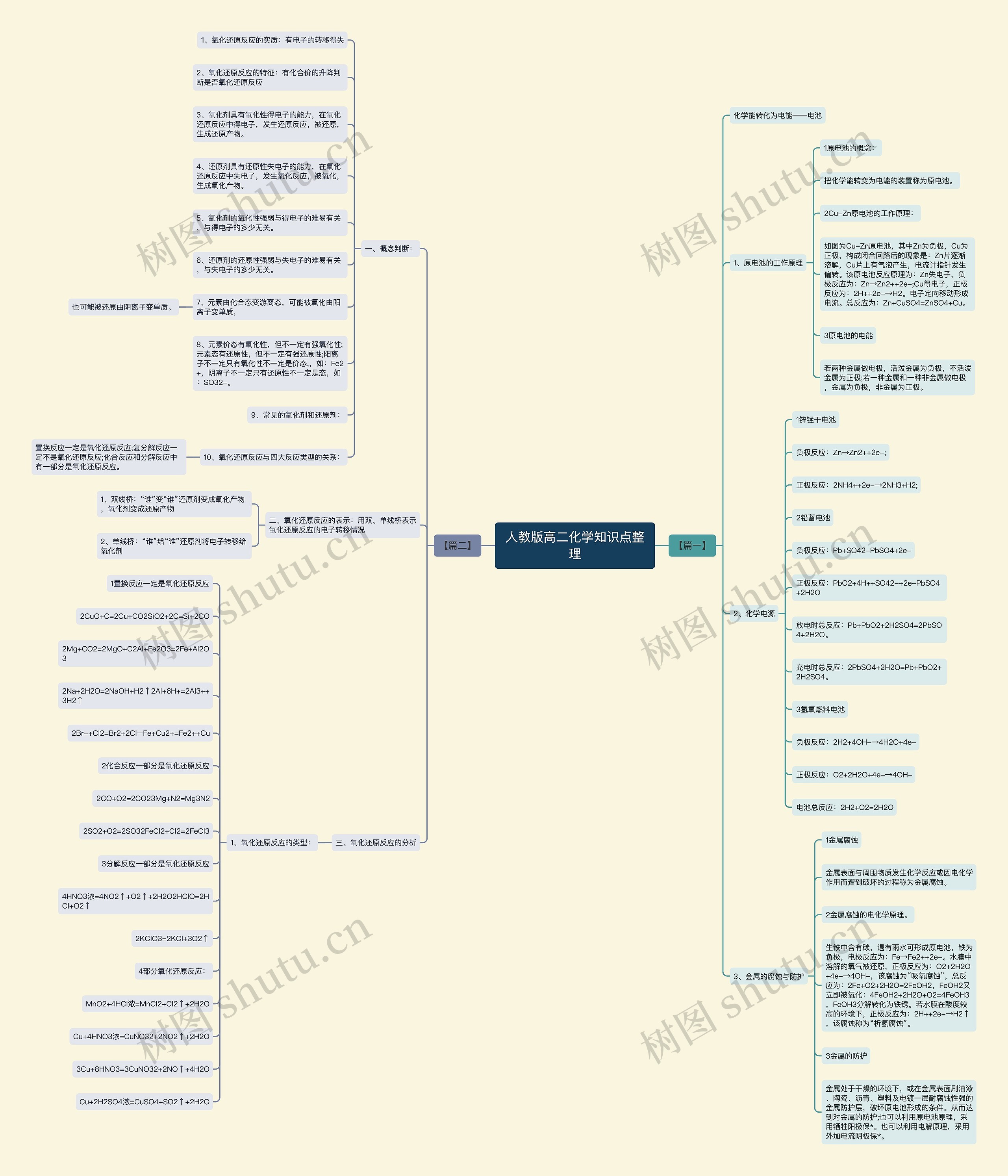
高二本身的知识体系而言,它主要是对高一知识的深入和新知识模块的补充。以数学为例,除去不同学校教学进度的不同,我们会在高二接触到更为深入的函数,也将开始学习从未接触过的复数、圆锥曲线等题型。树图网高二频道为你整理了《人教版高二化学知识点整理》希望对你有所帮助!
树图思维导图提供 人教版高二化学知识点整理 在线思维导图免费制作,点击“编辑”按钮,可对 人教版高二化学知识点整理 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:40a63d42519c79b668f2dcf5198a57e0
思维导图大纲
人教版高二化学知识点整理思维导图模板大纲
【篇一】
化学能转化为电能——电池
1、原电池的工作原理
1原电池的概念:
把化学能转变为电能的装置称为原电池。
2Cu-Zn原电池的工作原理:
如图为Cu-Zn原电池,其中Zn为负极,Cu为正极,构成闭合回路后的现象是:Zn片逐渐溶解,Cu片上有气泡产生,电流计指针发生偏转。该原电池反应原理为:Zn失电子,负极反应为:Zn→Zn2++2e-;Cu得电子,正极反应为:2H++2e-→H2。电子定向移动形成电流。总反应为:Zn+CuSO4=ZnSO4+Cu。
3原电池的电能
若两种金属做电极,活泼金属为负极,不活泼金属为正极;若一种金属和一种非金属做电极,金属为负极,非金属为正极。
2、化学电源
1锌锰干电池
负极反应:Zn→Zn2++2e-;
正极反应:2NH4++2e-→2NH3+H2;
2铅蓄电池
负极反应:Pb+SO42-PbSO4+2e-
正极反应:PbO2+4H++SO42-+2e-PbSO4+2H2O
放电时总反应:Pb+PbO2+2H2SO4=2PbSO4+2H2O。
充电时总反应:2PbSO4+2H2O=Pb+PbO2+2H2SO4。
3氢氧燃料电池
负极反应:2H2+4OH-→4H2O+4e-
正极反应:O2+2H2O+4e-→4OH-
电池总反应:2H2+O2=2H2O
3、金属的腐蚀与防护
1金属腐蚀
金属表面与周围物质发生化学反应或因电化学作用而遭到破坏的过程称为金属腐蚀。
2金属腐蚀的电化学原理。
生铁中含有碳,遇有雨水可形成原电池,铁为负极,电极反应为:Fe→Fe2++2e-。水膜中溶解的氧气被还原,正极反应为:O2+2H2O+4e-→4OH-,该腐蚀为“吸氧腐蚀”,总反应为:2Fe+O2+2H2O=2FeOH2,FeOH2又立即被氧化:4FeOH2+2H2O+O2=4FeOH3,FeOH3分解转化为铁锈。若水膜在酸度较高的环境下,正极反应为:2H++2e-→H2↑,该腐蚀称为“析氢腐蚀”。
3金属的防护
金属处于干燥的环境下,或在金属表面刷油漆、陶瓷、沥青、塑料及电镀一层耐腐蚀性强的金属防护层,破坏原电池形成的条件。从而达到对金属的防护;也可以利用原电池原理,采用牺牲阳极保*。也可以利用电解原理,采用外加电流阴极保*。
【篇二】
一、概念判断:
1、氧化还原反应的实质:有电子的转移得失
2、氧化还原反应的特征:有化合价的升降判断是否氧化还原反应
3、氧化剂具有氧化性得电子的能力,在氧化还原反应中得电子,发生还原反应,被还原,生成还原产物。
4、还原剂具有还原性失电子的能力,在氧化还原反应中失电子,发生氧化反应,被氧化,生成氧化产物。
5、氧化剂的氧化性强弱与得电子的难易有关,与得电子的多少无关。
6、还原剂的还原性强弱与失电子的难易有关,与失电子的多少无关。
7、元素由化合态变游离态,可能被氧化由阳离子变单质,
也可能被还原由阴离子变单质。
8、元素价态有氧化性,但不一定有强氧化性;元素态有还原性,但不一定有强还原性;阳离子不一定只有氧化性不一定是价态,,如:Fe2+,阴离子不一定只有还原性不一定是态,如:SO32-。
9、常见的氧化剂和还原剂:
10、氧化还原反应与四大反应类型的关系:
置换反应一定是氧化还原反应;复分解反应一定不是氧化还原反应;化合反应和分解反应中有一部分是氧化还原反应。
二、氧化还原反应的表示:用双、单线桥表示氧化还原反应的电子转移情况
1、双线桥:“谁”变“谁”还原剂变成氧化产物,氧化剂变成还原产物
2、单线桥:“谁”给“谁”还原剂将电子转移给氧化剂
三、氧化还原反应的分析
1、氧化还原反应的类型:
1置换反应一定是氧化还原反应
2CuO+C=2Cu+CO2SiO2+2C=Si+2CO
2Mg+CO2=2MgO+C2Al+Fe2O3=2Fe+Al2O3
2Na+2H2O=2NaOH+H2↑2Al+6H+=2Al3++3H2↑
2Br-+Cl2=Br2+2Cl–Fe+Cu2+=Fe2++Cu
2化合反应一部分是氧化还原反应
2CO+O2=2CO23Mg+N2=Mg3N2
2SO2+O2=2SO32FeCl2+Cl2=2FeCl3
3分解反应一部分是氧化还原反应
4HNO3浓=4NO2↑+O2↑+2H2O2HClO=2HCl+O2↑
2KClO3=2KCl+3O2↑
4部分氧化还原反应:
MnO2+4HCl浓=MnCl2+Cl2↑+2H2O
Cu+4HNO3浓=CuNO32+2NO2↑+2H2O
3Cu+8HNO3=3CuNO32+2NO↑+4H2O
Cu+2H2SO4浓=CuSO4+SO2↑+2H2O
相关思维导图模板

树图思维导图提供 第1章 化工设计基本知识 在线思维导图免费制作,点击“编辑”按钮,可对 第1章 化工设计基本知识 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:70ec0519ed26419068a32a511862aadd

树图思维导图提供 工艺流程图 在线思维导图免费制作,点击“编辑”按钮,可对 工艺流程图 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:a8e31ea83041e28a9ece5f7d7121fc30






 上海工商
上海工商