化学最易考离子方程式汇总,离子方程式书写规则思维导图

在学习中,很多人都经常追着老师们要知识点吧,知识点在教育实践中,是指对某一个知识的泛称。掌握知识点是我们提高成绩的关键!
树图思维导图提供 化学最易考离子方程式汇总,离子方程式书写规则 在线思维导图免费制作,点击“编辑”按钮,可对 化学最易考离子方程式汇总,离子方程式书写规则 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:53cec9aec6c6d256abbee1860e79e290
思维导图大纲
化学最易考离子方程式汇总,离子方程式书写规则思维导图模板大纲
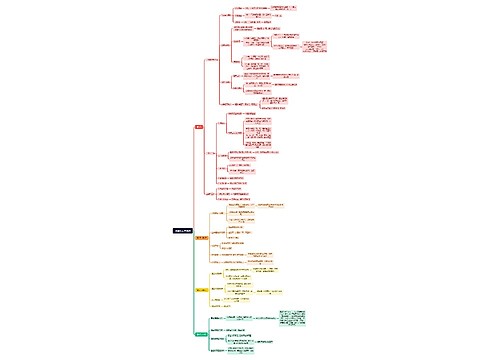
一、化学最易考离子方程式汇总
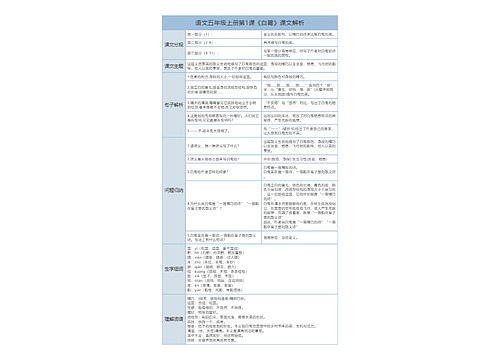
一、离子反应常见类型:
1、复分解型离子反应:例:Ag++Cl-=AgCl↓2H++CO32- =CO2↑+H2O
2、置换反应型:例:Zn+2H+=Zn2++H2 ↑ Cl2+2I-=2Cl-+I2
3、盐类水解型:例:NH4++H2O==NH3·H2O+H+ CH3COO-+H2O ==CH3COOH+0H-
4、复杂的氧化还原型:例:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O 另外还有生成物中有络合物时的离子反应等。
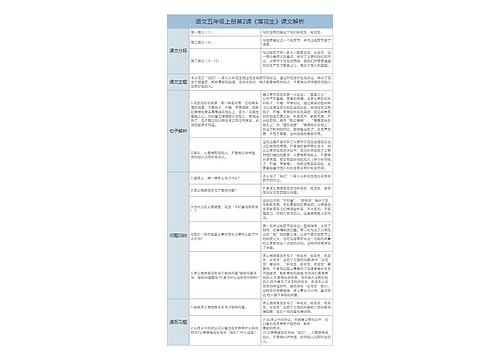
二、离子方程式书写规则:
1、只能将强电解质(指溶于水中的强电解质)写出离子形式,其它(包括难溶强电解质)一律写成分子形式。如碳酸钙与盐酸的反应:CaCO3+2H+=Ca2++CO2↑+H2O 因此熟记哪些物质是强电解质、哪些强电解质能溶于水是写好离子方程式的基础和关键。
2、不在水溶液中反应的离子反应,不能书写离子方程式。如铜与浓H2SO4的反应,浓H2SO4与相应固体物质取HCI、HF、HNO3的反应,以及Ca(OH)2与NH4Cl制取NH3的反应。
3、碱性氧化物虽然是强电解质,但它只能用化学方程式写在离子方程式中。如CuO与盐酸的反应:CuO+2H+=Cu2++H2O
4、有酸式盐参加的离子反应,对于弱酸酸式根离子不能拆成H+和酸根阴离子(HSO4-除外)。 如NaHCO3溶液和NaOH溶液混合:HCO3-+OH-=CO32-+H2O不能写成:H++OH-=H2O
5、书写氧化还原反应的离子方程式时,首先写好参加反应的离子,然后确定氧化产物和还原产物,再用观察配平并补齐其它物质即可;书写盐类水解的离子方程式时,先写好发生水解的离子,然后确定产物,再配平并补足水分子即可。
6、必须遵守质量守恒和电荷守恒定律,即离子方程式不仅要配平原子个数,还要配平离子电荷数和得失电子数。如在FeCl2溶液中通入Cl2,其离子方程式不能写成: Fe2++Cl2=Fe3++2Cl-,因反应前后电荷不守恒,应写成:2Fe2++Cl2=Fe3++2Cl-。
7、不能因约简离子方程式中局部系数而破坏整体的关系量。如稀H2SO4和Ba(OH)2溶液的反应,若写出为:Ba2++OH-+H++SO42-=BaSO4+H2O就是错误的,正确应为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O。
二、高二学业水平考试考哪几科
高中学业水平考试共开考6个科目,分别是:物理、化学、生物、思想政治、历史、地理。
其中文科考生必须参加物理、化学、生物三科考试;理科考生和体育类考生必须参加思想政治、历史、地理三科考试;艺术类(音乐、美术)考生根据自己兼报的科目选择对应的学业水平考试科目。
按广东省普通高考改革调整方案,文、理科考生参加普通高考时,学业水平考试的三门学科成绩均达到c级以上的,才能参加第一批本科院校录取;
三门学科成绩中至少有两门达到c级、另一门达d级以上的才能参加第二批本科院校录取;
三门学科中至少有一门达到c级、另两门达d级以上的才能参加第三批专科院校的录取。另外,艺术类、体育类考生也要求三门学科中至少有两门达到d级以上,才能参加艺术、体育各批次的录取。
学业水平考试时间不同的省份都不相同的,但每年的学业水平考试总的来说在7月初和12月底,这些是看自己所在省份的准则。










 上海工商
上海工商