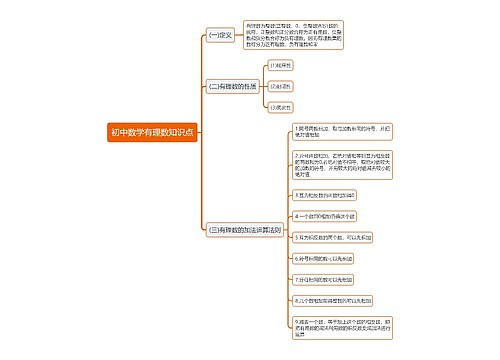
盐酸的性质及其用途有哪些思维导图

在学习理科时,物理是公认的最难学的一科,其次是化学。壹壹高考网小编整理了盐酸的性质及其用途,希望对您有所帮助。
树图思维导图提供 盐酸的性质及其用途有哪些 在线思维导图免费制作,点击“编辑”按钮,可对 盐酸的性质及其用途有哪些 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:37d61cc74cad9aceafad8e35dc76ecd5
思维导图大纲
盐酸的性质及其用途有哪些思维导图模板大纲
盐酸的定义
盐酸是氢氯酸的俗称,是氯化氢(HCl)气体的水溶液,为无色透明的一元强酸。盐酸具有极强的挥发性,因此打开盛有浓盐酸的容器后能在其上方看到白雾,实际为氯化氢挥发后与空气中的水蒸气结合产生的盐酸小液滴。盐酸(Hydrochloricacid)分子式HCl,相对分子质量36.46。盐酸为不同浓度的氯化氢水溶液,呈透明无色或黄色,有刺激性气味和强腐蚀性。易溶于水、乙醇、乙醚和油等。浓盐酸为含38%氯化氢的水溶液,相对密度1.19,熔点-112℃沸点-83.7℃。3.6%的盐酸,pH值为0.1。
盐酸的物理性质
盐酸是无色液体(工业用盐酸会因有杂质三价铁盐而略显黄色),有腐蚀性,为氯化氢的水溶液,具有刺激性气味,一般实验室使用的盐酸为0.1mol/L,pH=1。高中化学把盐酸和硫酸、硝酸、氢溴酸、氢碘酸、高氯酸合称为六大无机强酸。氯化氢与水混溶,浓盐酸溶于水有热量放出。溶于碱液并与碱液发生中和反应。能与乙醇任意混溶,氯化氢能溶于苯。由于浓盐酸具有挥发性,挥发出的氯化氢气体与空气中的水蒸气作用形成盐酸小液滴,所以会看到白雾。
盐酸的化学性质
盐酸遇紫色石蕊试液、pH试纸变红色,遇无色酚酞无明显现象(不变色)。
盐酸与碱发生中和反应,生成氯化物和水
HCl+NaOH==NaCl+HO
2HCl+Ca(OH)==CaCl+2HO
盐酸与活泼金属单质反应,生成氢气
Fe+2HCl==FeCl+H↑
Zn+2HCl==ZnCl+H↑
盐酸和碱性氧化物反应,生成盐和水
CuO+2HCl==CuCl+HO
MgO+2HCl==MgCl+HO
FeO+6HCl==2FeCl+3HO
FeO+8HCl==FeCl+2FeCl+4HO(铁有+2价和+3价)
盐酸和盐反应,生成新酸和新盐
2HCl+NaSO==SO↑+HO+2NaCl(亚硫酸易分解生成二氧化硫和水)
NaSO+2HCl==2NaCl+HO+SO↑+S↓(硫元素自身的氧化还原反应)
FeS+2HCl==HS↑+FeCl(实验室制取硫化氢)
盐酸与大部分碳酸盐或碳酸氢盐(HCO)反应,生成二氧化碳和水
CaCO+2HCl==CaCl+CO↑+HO(实验室制取二氧化碳)
NaHCO+HCl==NaCl+CO↑+HO
2KMnO+16HCl(浓)==2KCl+2MnCl+5Cl↑+8HO
4HCl(浓)+MnO====MnCl+2HO+Cl↑
14HCl(浓)+KCrO==3Cl↑+2CrCl+2KCl+7HO
NaClO+2HCl==NaCl+Cl↑+HO(氯元素的归中反应)
另外,盐酸能与硝酸银溶液反应,生成不溶于稀硝酸的氯化银。氯化银难溶于水,产生白色的凝乳状沉淀:
HCl+AgNO==HNO+AgCl↓
CHCOONa+HCl=CHCOOH+NaCl2HCl+NaSO==SO↑+HO+2NaCl
盐酸的毒理性质
危险性
健康危害:接触其蒸气或烟雾,可引起急性中毒:出现眼结膜炎,鼻及口腔粘膜有烧灼感,鼻出血、齿龈出血,气管炎等。误服可引起消化道灼伤、溃疡形成,有可能引起胃穿孔、腹膜炎等。眼和皮肤接触可致灼伤。
慢性影响:长期接触,引起慢性鼻炎、慢性支气管炎、牙齿酸蚀症及皮肤损害。
环境危害:对环境有危害,对水体和土壤可造成污染。
燃爆危险:该品不燃。具强腐蚀性、强刺激性,可致人体灼伤。
相关思维导图模板

树图思维导图提供 乌审旗国有投资集团有限公司 在线思维导图免费制作,点击“编辑”按钮,可对 乌审旗国有投资集团有限公司 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:5a28142386bd70b085d0dfa0b38ffb1d

树图思维导图提供 说文解字戏美国总统大选 在线思维导图免费制作,点击“编辑”按钮,可对 说文解字戏美国总统大选 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:062e27e31bfd81ad6f3ed78f2a4c7de2









 上海工商
上海工商