医疗器械注册|备案思维导图

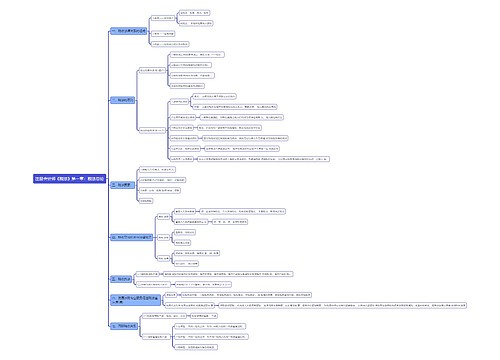
医疗器械注册|备案: 第八条 第一类医疗器械实行产品备案管理,第二类、第三类医疗器械实行产品注册管理。
树图思维导图提供 医疗器械注册|备案 在线思维导图免费制作,点击“编辑”按钮,可对 医疗器械注册|备案 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:687566ee5aff4bfd61fa24bdad25e63a
思维导图大纲
医疗器械注册|备案思维导图模板大纲
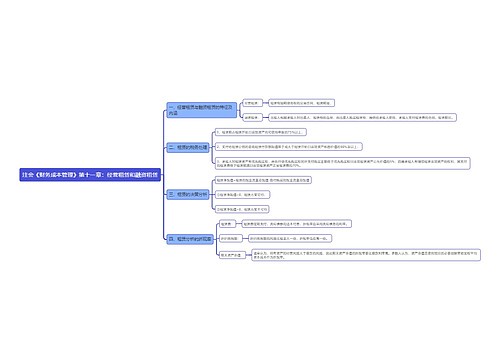
医疗器械注册|备案:
第八条 第一类医疗器械实行产品备案管理,第二类、第三类医疗器械实行产品注册管理。
第九条 第一类医疗器械产品备案和申请第二类、第三类医疗器械产品注册,应当提交下列资料:
(一)产品风险分析资料;
(二)产品技术要求;
(三)产品检验报告;
(四)临床评价资料;
(五)产品说明书及标签样稿;
(六)与产品研制、生产有关的质量管理体系文件;
(七)证明产品安全、有效所需的其他资料。
医疗器械注册申请人、备案人应当对所提交资料的真实性负责。
第十条 第一类医疗器械产品备案,由备案人向所在地设区的市级人民政府食品药品监督管理部门提交备案资料。医'学教育网|整理其中,产品检验报告可以是备案人的自检报告;临床评价资料不包括临床试验报告,可以是通过文献、同类产品临床使用获得的数据证明该医疗器械安全、有效的资料。
向我国境内出口第一类医疗器械的境外生产企业,由其在我国境内设立的代表机构或者指定我国境内的企业法人作为代理人,向国务院食品药品监督管理部门提交备案资料和备案人所在国(地区)主管部门准许该医疗器械上市销售的证明文件。
备案资料载明的事项发生变化的,应当向原备案部门变更备案。
第十一条 申请第二类医疗器械产品注册,注册申请人应当向所在地省、自治区、直辖市人民政府食品药品监督管理部门提交注册申请资料。申请第三类医疗器械产品注册,注册申请人应当向国务院食品药品监督管理部门提交注册申请资料。
向我国境内出口第二类、第三类医疗器械的境外生产企业,应当由其在我国境内设立的代表机构或者指定我国境内的企业法人作为代理人,向国务院食品药品监督管理部门提交注册申请资料和注册申请人所在国(地区)主管部门准许该医疗器械上市销售的证明文件。
第二类、第三类医疗器械产品注册申请资料中的产品检验报告应当是医疗器械检验机构出具的检验报告;临床评价资料应当包括临床试验报告,但依照本条例第十七条的规定免于进行临床试验的医疗器械除外。
第十二条 受理注册申请的食品药品监督管理部门应当自受理之日起3个工作日内将注册申请资料转交技术审评机构。技术审评机构应当在完成技术审评后向食品药品监督管理部门提交审评意见。
相关思维导图模板
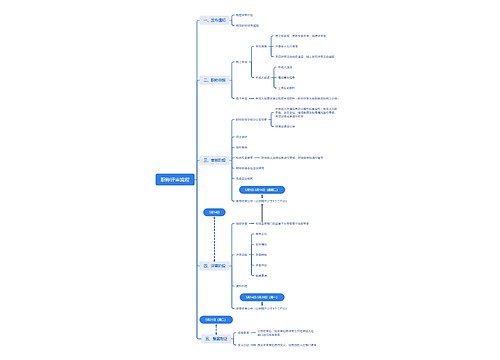

树图思维导图提供 职称评审流程 在线思维导图免费制作,点击“编辑”按钮,可对 职称评审流程 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:4307a5c448c047aa8adb9341e360db5d
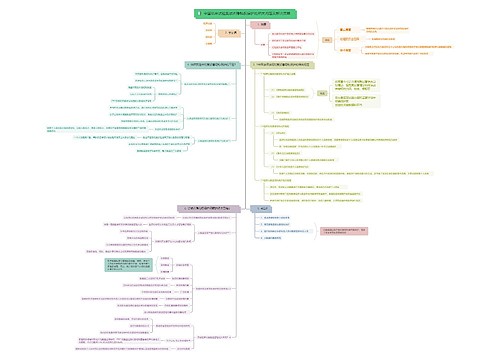

树图思维导图提供 中国临床试验受试者隐私权保护的相关问题及解决策略 在线思维导图免费制作,点击“编辑”按钮,可对 中国临床试验受试者隐私权保护的相关问题及解决策略 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:38e14f03459127cad536b763e9539599








 上海工商
上海工商