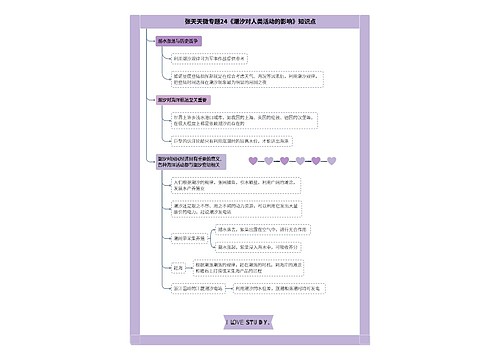
药事管理与法规:生物等效性试验的概念及相关规定思维导图

“生物等效性试验的概念及相关规定”是药事管理与法规的知识点,为了帮助广大考生备考,树图思维导图小编为大家整理出如下内容: 生物等效性试验,是指用生物利用度研究的方法,以药代动力学参数为指标,比较同一种药物的相同或者不同剂型的制剂,在相同的试验条件下,其活性成份吸收程度和速度有无统计学差异的人体试验。
树图思维导图提供 药事管理与法规:生物等效性试验的概念及相关规定 在线思维导图免费制作,点击“编辑”按钮,可对 药事管理与法规:生物等效性试验的概念及相关规定 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:ebfbf76609e1af7f2ac379fe729870e7
思维导图大纲
药事管理与法规:生物等效性试验的概念及相关规定思维导图模板大纲
生物等效性试验,是指用生物利用度研究的方法,以药代动力学参数为指标,比较同一种药物的相同或者不同剂型的制剂,在相同的试验条件下,其活性成份吸收程度和速度有无统计学差异的人体试验。
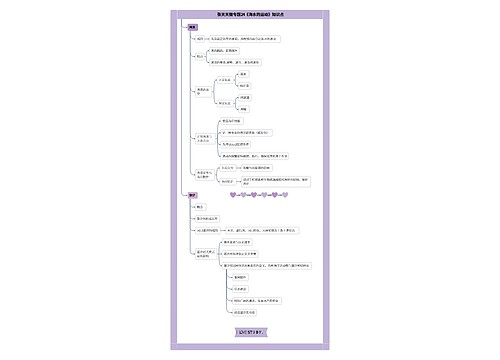
第三十二条药物临床试验的受试例数应当符合临床试验的目的和相关统计学的要求,并且不得少于本办法附件规定的zui低临床试验病例数。罕见病、特殊病种等情况,要求减少临床试验病例数或者免做临床试验的,应当在申请临床试验时提出,并经国家食品药品监督管理局审查批准。
第三十三条在菌毒种选种阶段制备的疫苗或者其他特殊药物,确无合适的动物模型且实验室无法评价其疗效的,在保证受试者安全的前提下,可以向国家食品药品监督管理局申请进行临床试验。
第三十四条药物临床试验批准后?,申请人应当从具有药物临床试验资格的机构中选择承担药物临床试验的机构。
第三十五条临床试验用药物应当在符合《药品生产质量管理规范》的车间制备。制备过程应当严格执行《药品生产质量管理规范》的要求。
申请人对临床试验用药物的质量负责。
第三十六条申请人可以按照其拟定的临床试验用样品标准自行检验临床试验用药物,也可以委托本办法确定的药品检验所进行检验;疫苗类制品、血液制品、国家食品药品监督管理局规定的其他生物制品,应当由国家食品药品监督管理局指定的药品检验所进行检验。
相关思维导图模板
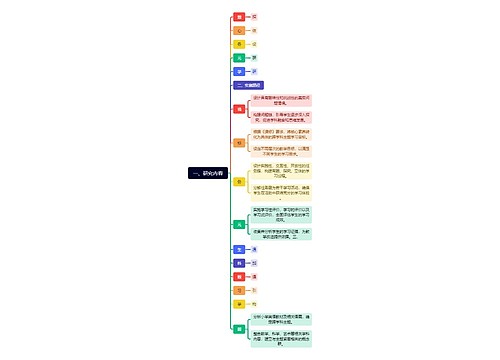

树图思维导图提供 一、研究内容 在线思维导图免费制作,点击“编辑”按钮,可对 一、研究内容 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:4f21797dd3e8b08f1951dfc24e7be94f


树图思维导图提供 904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查 在线思维导图免费制作,点击“编辑”按钮,可对 904名中国成年人第三磨牙相关知识、态度、行为和病史的横断面调查 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:10b9a8a2dd2fb4593f8130ef16c320fc










 上海工商
上海工商