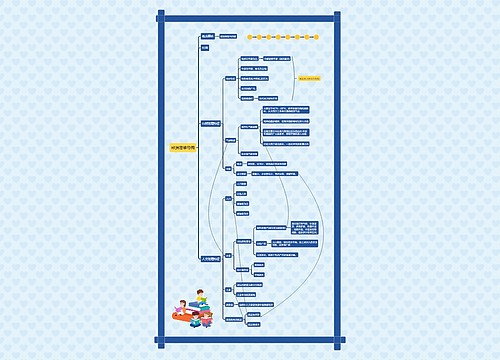
铝及其化合物思维导图
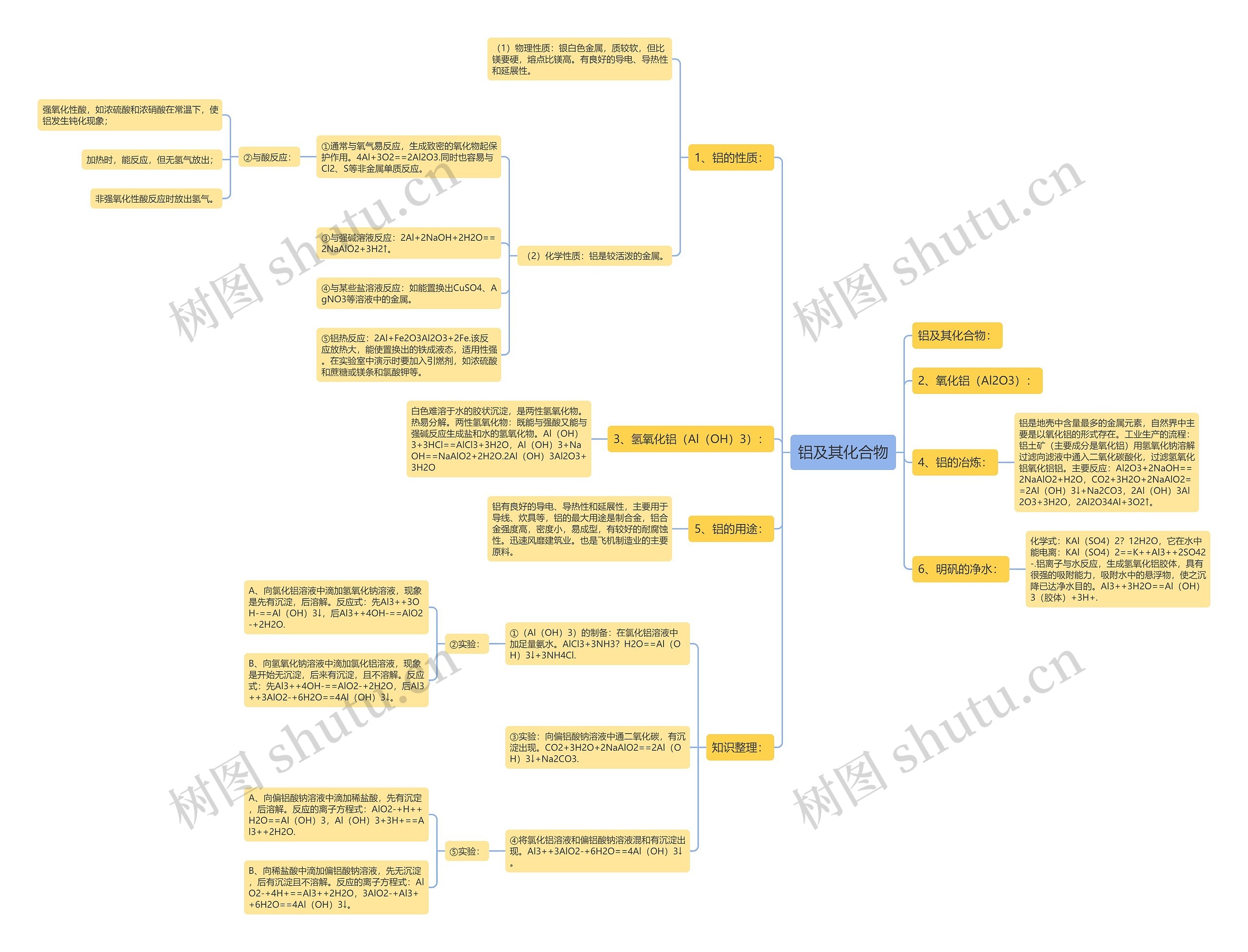
铝及其化合物: 1、铝的性质: (1)物理性质:银白色金属,质较软,但比镁要硬,熔点比镁高。有良好的导电、导热性和延展性。 (2)化学性质:铝是较活泼的金属。 ①通常与氧气易反应,生成致密的氧化物起保护作用。4Al+3O2==2Al2O3.同时也容易与Cl2、S等非金属单质反应。
树图思维导图提供 铝及其化合物 在线思维导图免费制作,点击“编辑”按钮,可对 铝及其化合物 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:b21a5cc7aa08f705f4918159fd880c5f
思维导图大纲
铝及其化合物思维导图模板大纲
铝及其化合物:
1、铝的性质:
(1)物理性质:银白色金属,质较软,但比镁要硬,熔点比镁高。有良好的导电、导热性和延展性。
(2)化学性质:铝是较活泼的金属。
①通常与氧气易反应,生成致密的氧化物起保护作用。4Al+3O2==2Al2O3.同时也容易与Cl2、S等非金属单质反应。
②与酸反应:
强氧化性酸,如浓硫酸和浓硝酸在常温下,使铝发生钝化现象;
加热时,能反应,但无氢气放出;
非强氧化性酸反应时放出氢气。
③与强碱溶液反应:2Al+2NaOH+2H2O==2NaAlO2+3H2↑。
④与某些盐溶液反应:如能置换出CuSO4、AgNO3等溶液中的金属。
⑤铝热反应:2Al+Fe2O3Al2O3+2Fe.该反应放热大,能使置换出的铁成液态,适用性强。在实验室中演示时要加入引燃剂,如浓硫酸和蔗糖或镁条和氯酸钾等。
2、氧化铝(Al2O3):
3、氢氧化铝(Al(OH)3):
白色难溶于水的胶状沉淀,是两性氢氧化物。热易分解。两性氢氧化物:既能与强酸又能与强碱反应生成盐和水的氢氧化物。Al(OH)3+3HCl==AlCl3+3H2O,Al(OH)3+NaOH==NaAlO2+2H2O.2Al(OH)3Al2O3+3H2O
4、铝的冶炼:
铝是地壳中含量最多的金属元素,自然界中主要是以氧化铝的形式存在。工业生产的流程:铝土矿(主要成分是氧化铝)用氢氧化钠溶解过滤向滤液中通入二氧化碳酸化,过滤氢氧化铝氧化铝铝。主要反应:Al2O3+2NaOH==2NaAlO2+H2O,CO2+3H2O+2NaAlO2==2Al(OH)3↓+Na2CO3,2Al(OH)3Al2O3+3H2O,2Al2O34Al+3O2↑。
5、铝的用途:
铝有良好的导电、导热性和延展性,主要用于导线、炊具等,铝的最大用途是制合金,铝合金强度高,密度小,易成型,有较好的耐腐蚀性。迅速风靡建筑业。也是飞机制造业的主要原料。
6、明矾的净水:
化学式:KAl(SO4)2?12H2O,它在水中能电离:KAl(SO4)2==K++Al3++2SO42-.铝离子与水反应,生成氢氧化铝胶体,具有很强的吸附能力,吸附水中的悬浮物,使之沉降已达净水目的。Al3++3H2O==Al(OH)3(胶体)+3H+.
知识整理:
①(Al(OH)3)的制备:在氯化铝溶液中加足量氨水。AlCl3+3NH3?H2O==Al(OH)3↓+3NH4Cl.
②实验:
A、向氯化铝溶液中滴加氢氧化钠溶液,现象是先有沉淀,后溶解。反应式:先Al3++3OH-==Al(OH)3↓,后Al3++4OH-==AlO2-+2H2O.
B、向氢氧化钠溶液中滴加氯化铝溶液,现象是开始无沉淀,后来有沉淀,且不溶解。反应式:先Al3++4OH-==AlO2-+2H2O,后Al3++3AlO2-+6H2O==4Al(OH)3↓。
③实验:向偏铝酸钠溶液中通二氧化碳,有沉淀出现。CO2+3H2O+2NaAlO2==2Al(OH)3↓+Na2CO3.
④将氯化铝溶液和偏铝酸钠溶液混和有沉淀出现。Al3++3AlO2-+6H2O==4Al(OH)3↓。
⑤实验:
A、向偏铝酸钠溶液中滴加稀盐酸,先有沉定,后溶解。反应的离子方程式:AlO2-+H++H2O==Al(OH)3,Al(OH)3+3H+==Al3++2H2O.
B、向稀盐酸中滴加偏铝酸钠溶液,先无沉淀,后有沉淀且不溶解。反应的离子方程式:AlO2-+4H+==Al3++2H2O,3AlO2-+Al3++6H2O==4Al(OH)3↓。
相关思维导图模板

树图思维导图提供 微生物的生长及其控制 在线思维导图免费制作,点击“编辑”按钮,可对 微生物的生长及其控制 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:e3f7508625536c9f8227e5d0a05aa35f

树图思维导图提供 第二章 组织及其绩效影响因素 在线思维导图免费制作,点击“编辑”按钮,可对 第二章 组织及其绩效影响因素 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:1919a947f88bc2d8550efe05fd639dac









 上海工商
上海工商