医疗器械法律是怎样思维导图
医疗器械法律法规主要有以下几部:第一、医疗器械监督管理条例;第二、产品质量法;第三、药品监督管理局发布的局令10号令、12号令、16号令等;第四、地方药品监督管理局发布的各类考核、检查、备案、注册办法。接下来,树图网的小编为您介绍关于医疗器械法律是怎样的相关内容!欢迎阅读!
树图思维导图提供 医疗器械法律是怎样 在线思维导图免费制作,点击“编辑”按钮,可对 医疗器械法律是怎样 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:d5c28dbdbae330904ba0d857f88ef096
思维导图大纲
医疗器械法律是怎样思维导图模板大纲
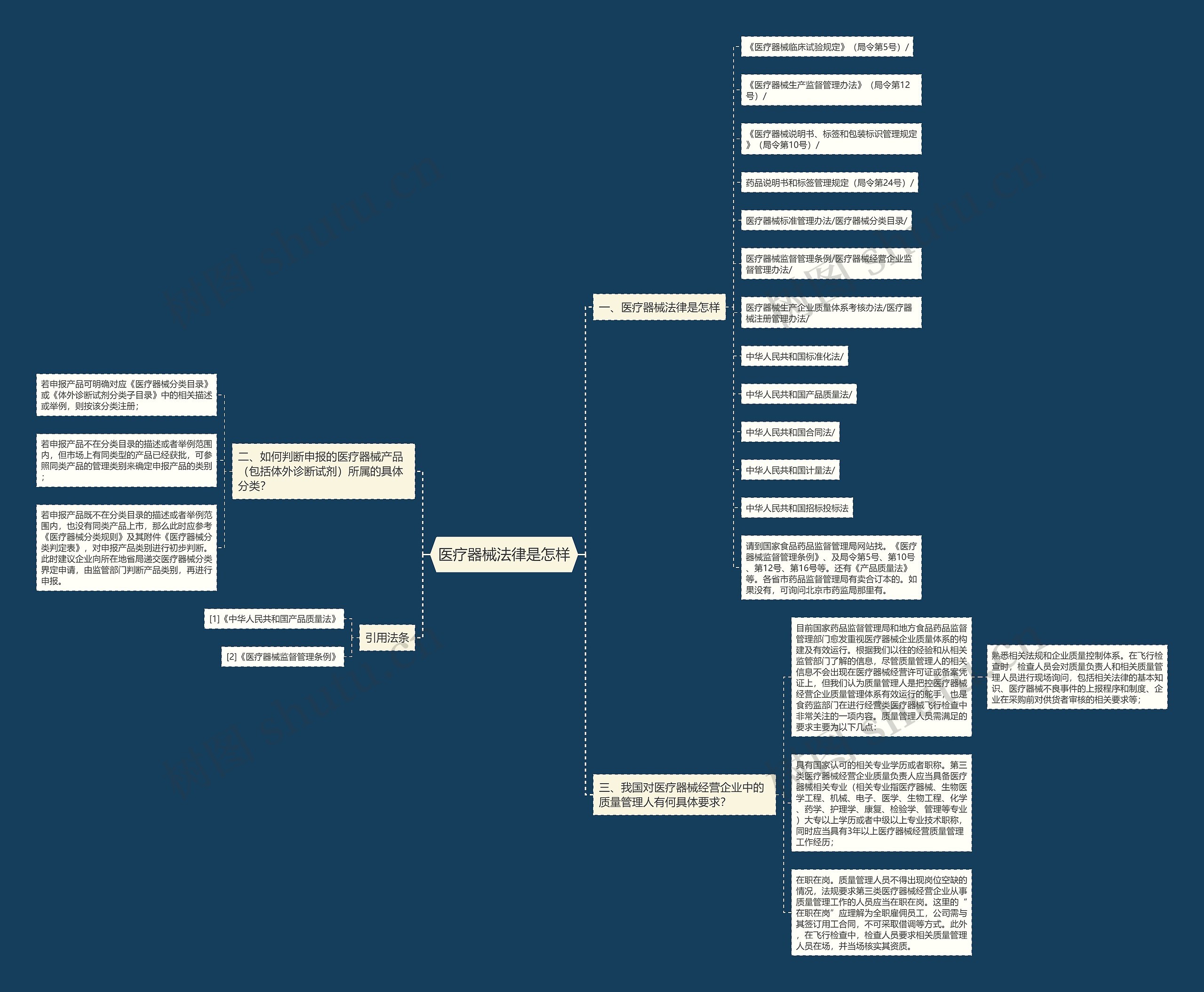
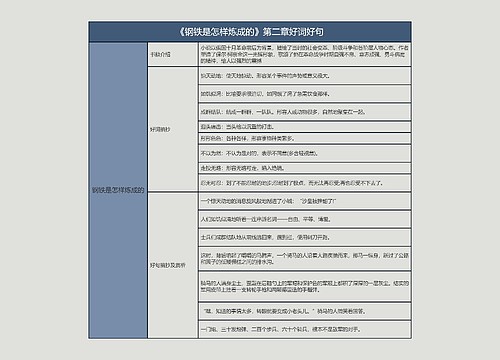
一、医疗器械法律是怎样
《医疗器械临床试验规定》(局令第5号)/
《医疗器械生产监督管理办法》(局令第12号)/
《医疗器械说明书、标签和包装标识管理规定》(局令第10号)/
药品说明书和标签管理规定(局令第24号)/
医疗器械标准管理办法/医疗器械分类目录/
医疗器械监督管理条例/医疗器械经营企业监督管理办法/
医疗器械生产企业质量体系考核办法/医疗器械注册管理办法/
中华人民共和国标准化法/
中华人民共和国产品质量法/
中华人民共和国合同法/
中华人民共和国计量法/
中华人民共和国招标投标法
请到国家食品药品监督管理局网站找。《医疗器械监督管理条例》、及局令第5号、第10号、第12号、第16号等。还有《产品质量法》等。各省市药品监督管理局有卖合订本的。如果没有,可询问北京市药监局那里有。
二、如何判断申报的医疗器械产品(包括体外诊断试剂)所属的具体分类?
若申报产品可明确对应《医疗器械分类目录》或《体外诊断试剂分类子目录》中的相关描述或举例,则按该分类注册;
若申报产品不在分类目录的描述或者举例范围内,但市场上有同类型的产品已经获批,可参照同类产品的管理类别来确定申报产品的类别;
若申报产品既不在分类目录的描述或者举例范围内,也没有同类产品上市,那么此时应参考《医疗器械分类规则》及其附件《医疗器械分类判定表》,对申报产品类别进行初步判断。此时建议企业向所在地省局递交医疗器械分类界定申请,由监管部门判断产品类别,再进行申报。
三、我国对医疗器械经营企业中的质量管理人有何具体要求?
目前国家药品监督管理局和地方食品药品监督管理部门愈发重视医疗器械企业质量体系的构建及有效运行。根据我们以往的经验和从相关监管部门了解的信息,尽管质量管理人的相关信息不会出现在医疗器械经营许可证或备案凭证上,但我们认为质量管理人是把控医疗器械经营企业质量管理体系有效运行的舵手,也是食药监部门在进行经营类医疗器械飞行检查中非常关注的一项内容。质量管理人员需满足的要求主要为以下几点:
熟悉相关法规和企业质量控制体系。在飞行检查时,检查人员会对质量负责人和相关质量管理人员进行现场询问,包括相关法律的基本知识、医疗器械不良事件的上报程序和制度、企业在采购前对供货者审核的相关要求等;
具有国家认可的相关专业学历或者职称。第三类医疗器械经营企业质量负责人应当具备医疗器械相关专业(相关专业指医疗器械、生物医学工程、机械、电子、医学、生物工程、化学、药学、护理学、康复、检验学、管理等专业)大专以上学历或者中级以上专业技术职称,同时应当具有3年以上医疗器械经营质量管理工作经历;
在职在岗。质量管理人员不得出现岗位空缺的情况,法规要求第三类医疗器械经营企业从事质量管理工作的人员应当在职在岗。这里的“在职在岗”应理解为全职雇佣员工,公司需与其签订用工合同,不可采取借调等方式。此外,在飞行检查中,检查人员要求相关质量管理人员在场,并当场核实其资质。
引用法条
[1]《中华人民共和国产品质量法》
[2]《医疗器械监督管理条例》
相关思维导图模板


树图思维导图提供 合同法内容介绍 在线思维导图免费制作,点击“编辑”按钮,可对 合同法内容介绍 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:5ed860ec61ababe1d6fa86f4c42f57ad


树图思维导图提供 八年级物理(第三单元) 在线思维导图免费制作,点击“编辑”按钮,可对 八年级物理(第三单元) 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:13a65c3defeb87004aa1c7c846526ef1





 上海工商
上海工商