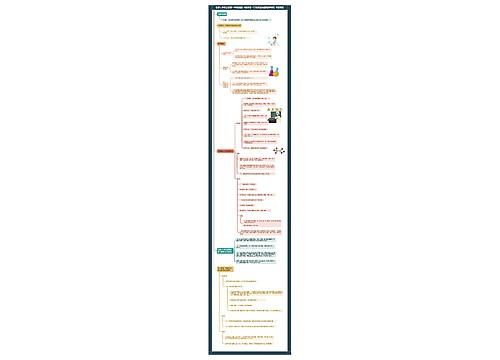
高中化学必修二化学能与热能思维导图
本章节讲述了化学能与热能的知识点,主要内容包括化学能转化为电能的方式和原电池原理等
树图思维导图提供 高中化学必修二化学能与热能思维导图 在线思维导图免费制作,点击“编辑”按钮,可对 高中化学必修二化学能与热能思维导图 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:e1131ac0ed850e56c2d37c4f32067a32
思维导图大纲
化学能与热能思维导图模板大纲
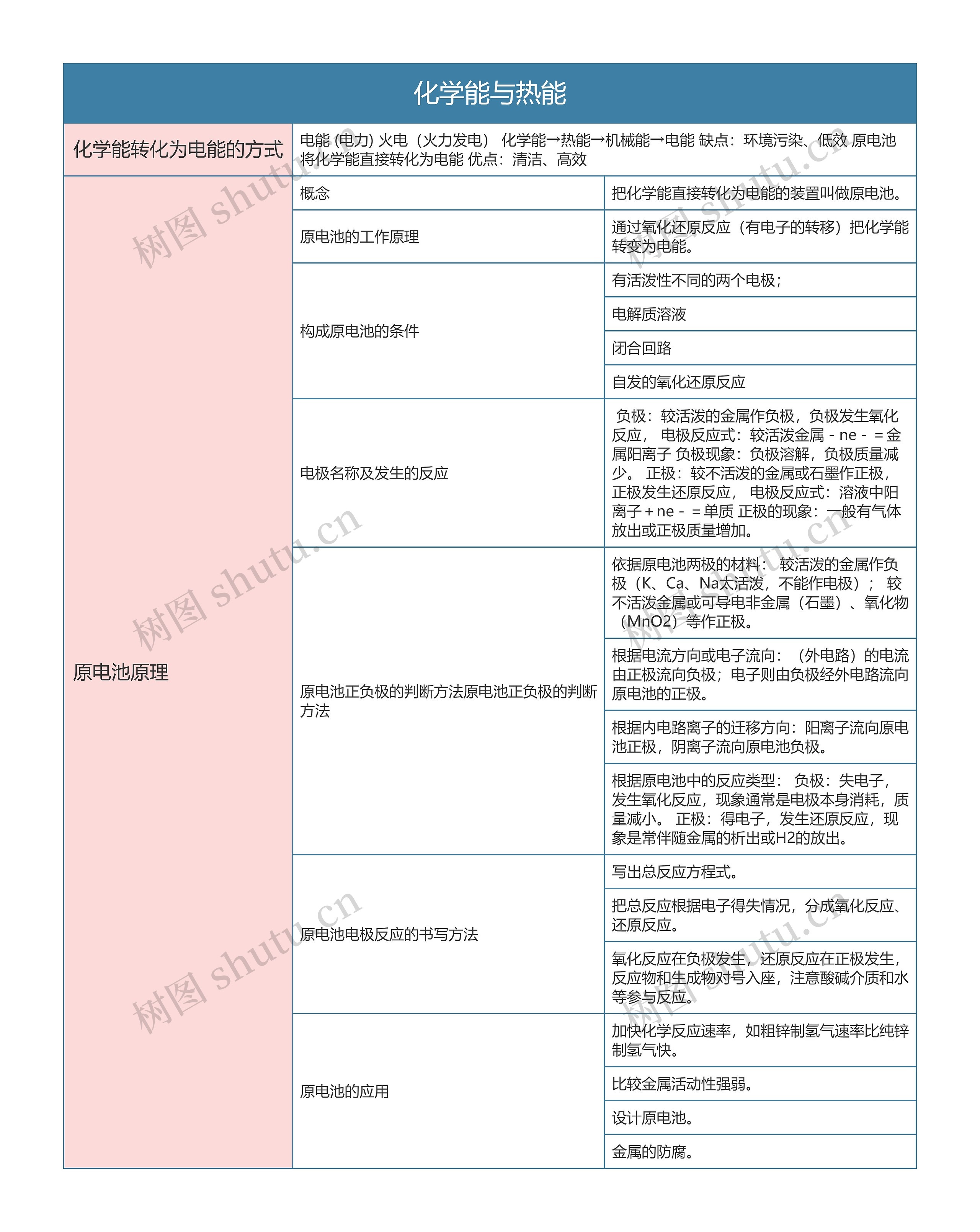
化学能转化为电能的方式
电能 (电力) 火电(火力发电) 化学能→热能→机械能→电能 缺点:环境污染、低效 原电池 将化学能直接转化为电能 优点:清洁、高效
原电池原理
概念
把化学能直接转化为电能的装置叫做原电池。
原电池的工作原理
通过氧化还原反应(有电子的转移)把化学能转变为电能。
构成原电池的条件
有活泼性不同的两个电极;
电解质溶液
闭合回路
自发的氧化还原反应
电极名称及发生的反应
负极:较活泼的金属作负极,负极发生氧化反应, 电极反应式:较活泼金属-ne-=金属阳离子 负极现象:负极溶解,负极质量减少。 正极:较不活泼的金属或石墨作正极,正极发生还原反应, 电极反应式:溶液中阳离子+ne-=单质 正极的现象:一般有气体放出或正极质量增加。
原电池正负极的判断方法原电池正负极的判断方法
依据原电池两极的材料: 较活泼的金属作负极(K、Ca、Na太活泼,不能作电极); 较不活泼金属或可导电非金属(石墨)、氧化物(MnO2)等作正极。
根据电流方向或电子流向:(外电路)的电流由正极流向负极;电子则由负极经外电路流向原电池的正极。
根据内电路离子的迁移方向:阳离子流向原电池正极,阴离子流向原电池负极。
根据原电池中的反应类型: 负极:失电子,发生氧化反应,现象通常是电极本身消耗,质量减小。 正极:得电子,发生还原反应,现象是常伴随金属的析出或H2的放出。
原电池电极反应的书写方法
写出总反应方程式。
把总反应根据电子得失情况,分成氧化反应、还原反应。
氧化反应在负极发生,还原反应在正极发生,反应物和生成物对号入座,注意酸碱介质和水等参与反应。
原电池的应用
加快化学反应速率,如粗锌制氢气速率比纯锌制氢气快。
比较金属活动性强弱。
设计原电池。
金属的防腐。
相关思维导图模板
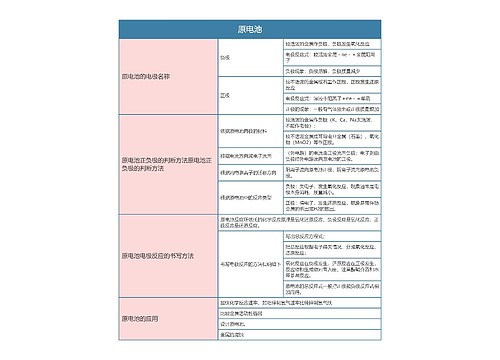
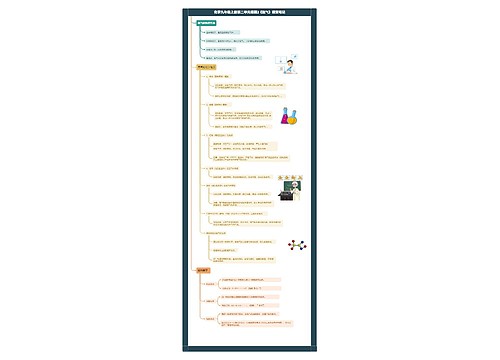
树图思维导图提供 高中化学必修二原电池思维导图 在线思维导图免费制作,点击“编辑”按钮,可对 高中化学必修二原电池思维导图 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:fe690cfb02c84f3c80357daf02f5f095
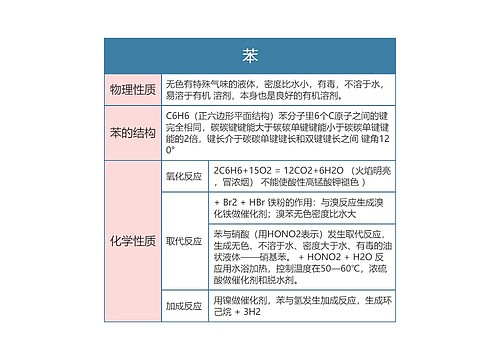
树图思维导图提供 高中化学必修二苯思维导图 在线思维导图免费制作,点击“编辑”按钮,可对 高中化学必修二苯思维导图 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:d9615247095556e532acf5f4101d07f0










 上海工商
上海工商