执业药师《法规》知识点:药品生产质量管理与风险管理思维导图
本思维导图主要介绍医学专业执业药师《法规》知识点:药品生产质量管理与风险管理
树图思维导图提供 执业药师《法规》知识点:药品生产质量管理与风险管理 在线思维导图免费制作,点击“编辑”按钮,可对 执业药师《法规》知识点:药品生产质量管理与风险管理 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:d30841e3e983e3d313ea17cc6e9bd7a2
思维导图大纲
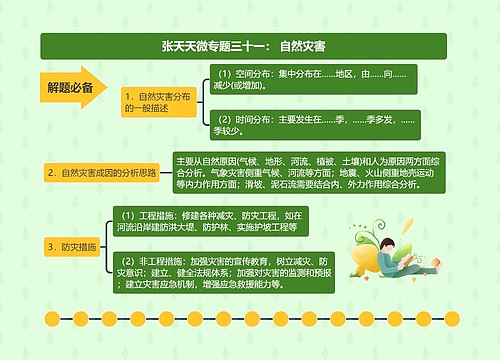
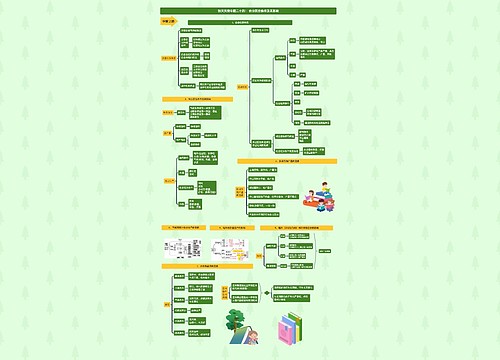
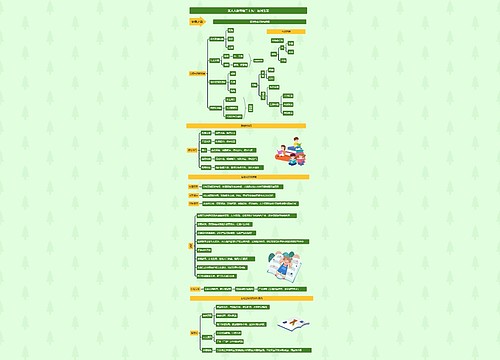
执业药师《法规》知识点:药品生产质量管理与风险管理思维导图模板大纲
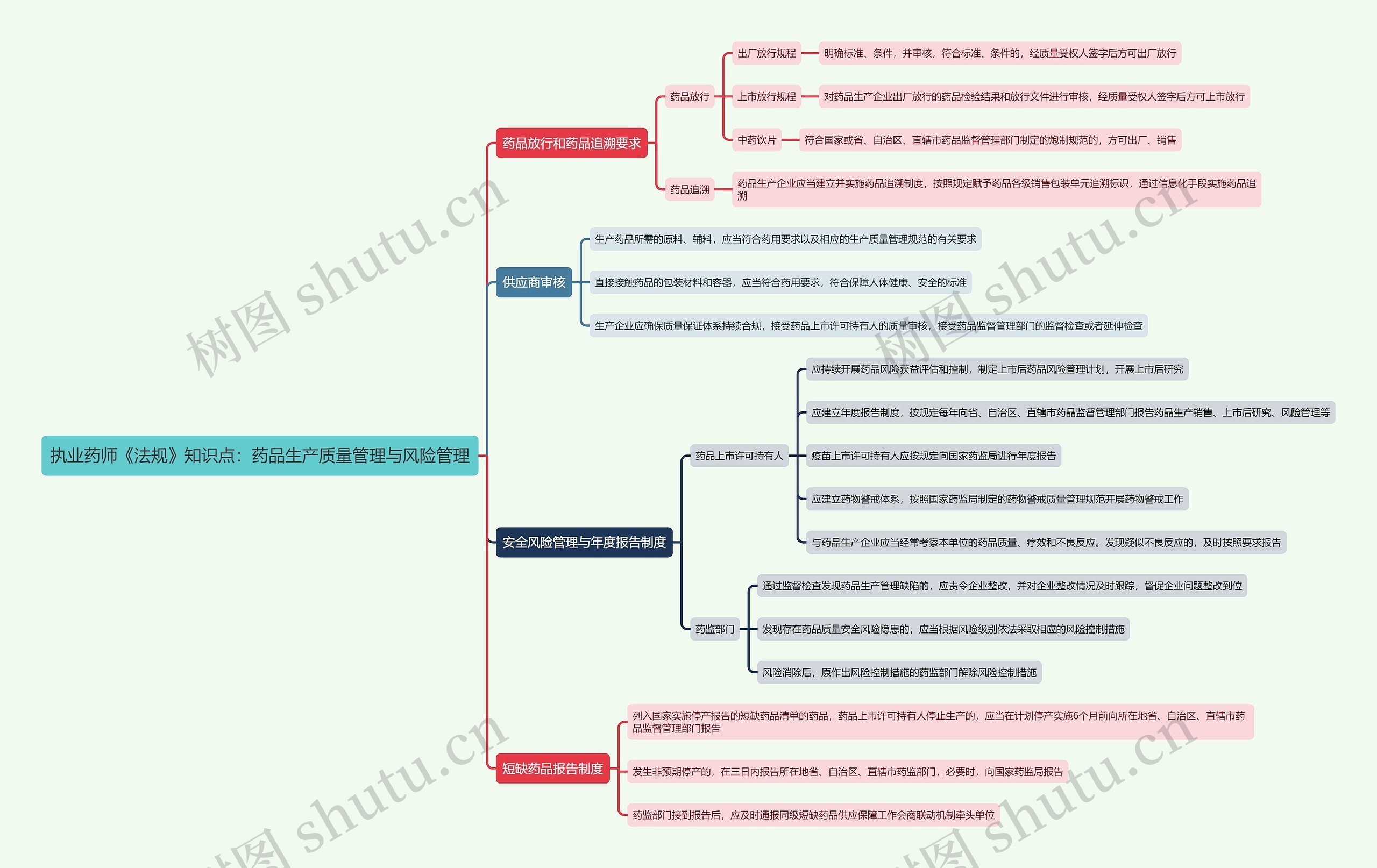
药品放行和药品追溯要求
药品放行
出厂放行规程
明确标准、条件,并审核,符合标准、条件的,经质量受权人签字后方可出厂放行
上市放行规程
对药品生产企业出厂放行的药品检验结果和放行文件进行审核,经质量受权人签字后方可上市放行
中药饮片
符合国家或省、自治区、直辖市药品监督管理部门制定的炮制规范的,方可出厂、销售
药品追溯
药品生产企业应当建立并实施药品追溯制度,按照规定赋予药品各级销售包装单元追溯标识,通过信息化手段实施药品追溯
供应商审核
生产药品所需的原料、辅料,应当符合药用要求以及相应的生产质量管理规范的有关要求
直接接触药品的包装材料和容器,应当符合药用要求,符合保障人体健康、安全的标准
生产企业应确保质量保证体系持续合规,接受药品上市许可持有人的质量审核,接受药品监督管理部门的监督检查或者延伸检查
安全风险管理与年度报告制度
药品上市许可持有人
应持续开展药品风险获益评估和控制,制定上市后药品风险管理计划,开展上市后研究
应建立年度报告制度,按规定每年向省、自治区、直辖市药品监督管理部门报告药品生产销售、上市后研究、风险管理等
疫苗上市许可持有人应按规定向国家药监局进行年度报告
应建立药物警戒体系,按照国家药监局制定的药物警戒质量管理规范开展药物警戒工作
与药品生产企业应当经常考察本单位的药品质量、疗效和不良反应。发现疑似不良反应的,及时按照要求报告
药监部门
通过监督检查发现药品生产管理缺陷的,应责令企业整改,并对企业整改情况及时跟踪,督促企业问题整改到位
发现存在药品质量安全风险隐患的,应当根据风险级别依法采取相应的风险控制措施
风险消除后,原作出风险控制措施的药监部门解除风险控制措施
短缺药品报告制度
列入国家实施停产报告的短缺药品清单的药品,药品上市许可持有人停止生产的,应当在计划停产实施6个月前向所在地省、自治区、直辖市药品监督管理部门报告
发生非预期停产的,在三日内报告所在地省、自治区、直辖市药监部门,必要时,向国家药监局报告
药监部门接到报告后,应及时通报同级短缺药品供应保障工作会商联动机制牵头单位
相关思维导图模板

树图思维导图提供 9.战斗的基督教 在线思维导图免费制作,点击“编辑”按钮,可对 9.战斗的基督教 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:33d168acd0cd9f767f809c7a5df86e3a

树图思维导图提供 第六章 群体传播与组织传播_副本 在线思维导图免费制作,点击“编辑”按钮,可对 第六章 群体传播与组织传播_副本 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:1672f555831e7d9a3bb2cf2fb792cb49






 上海工商
上海工商