药理学 新药临床研究思维导图

本章节讲述了 新药临床研究的知识点,主要内容包括药物临床试验质量管理规范和伦理委员会等
树图思维导图提供 药理学 新药临床研究思维导图 在线思维导图免费制作,点击“编辑”按钮,可对 药理学 新药临床研究思维导图 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:7d13bc2544121238c956bb2ac691b0ca
思维导图大纲
新药临床研究思维导图模板大纲
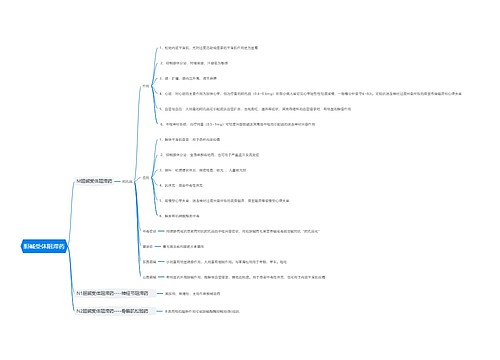
药物临床试验质量管理规范
是临床试验全过程的标准规定,包括方案设计、组织实施、监查、稽查、记录、分析总结和报告。是对临床试验所作的标准化、规范化管理的规定。
原则:凡是以人体为对象的生物医学研究,均应遵循GCP的原则。
核心:保证试验科学上完整、伦理上正确。
GCP改进研究质量、可以保护临床试验,防止做假、可以在遇到法律纠纷时保护临床试验、是现代国际新药开发授权上市和新药申请所需要的、确保病人的安全和权利。
伦理委员会
由医学专业人员、法律专家,非医务人员及来自其他单位人员组成的独立组织(≥5)。
由不同性别人员组成。
其职责为核查临床试验方案及附件是否合乎道德,并为之提供公众保证,确保受试者的安全、健康和权益受到保护。
该委员会的组成和一切活动不应受临床试验组织和实施者的干扰或影响。
试验方案需经伦理委员会审议同意并签署批准意见后方能实施。
在试验进行期间,试验方案的任何修改均应经伦理委员会批准后方能执行。
试验中发生严重不良事件,均应向伦理委员会报告。
知情同意书
是每位受试者表示自愿参加某一试验的文件证明。研究者须向受试者说明试验性质、试验目的、可能的受益和危险、可供选用的其他治疗方法以及符合《赫尔辛基宣言》规定的受试者的权利和义务等,使受试者充分了解后表达其同意。
语言要通俗,对于不良反应要充分说明。
Informed Consent (IC)。
知情:受试者知晓和明了与临床试验有关的必要信息。
同意:受试者自愿确认其同意参加该项临床试验的过程,须以签名和注明日期的知情同意书作为文件证明。
相关思维导图模板

树图思维导图提供 一、研究内容 在线思维导图免费制作,点击“编辑”按钮,可对 一、研究内容 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:4f21797dd3e8b08f1951dfc24e7be94f


树图思维导图提供 骨料和海外双极驱动,一体化布局领跑行业 在线思维导图免费制作,点击“编辑”按钮,可对 骨料和海外双极驱动,一体化布局领跑行业 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:3b02aa55260be20b1cc2be8dc21730b9




 上海工商
上海工商