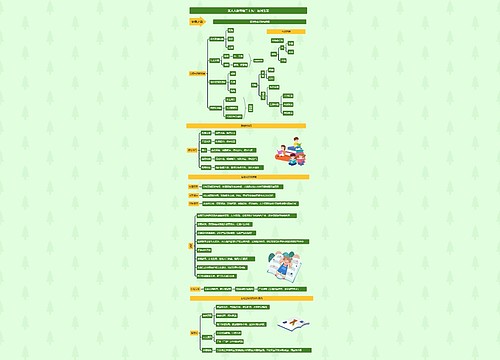
高三化学必考知识点归纳思维导图

有很多的学生在复习高三化学时,因为之前没有对知识进行系统的总结,导致复习时整体的效率低下。
树图思维导图提供 高三化学必考知识点归纳 在线思维导图免费制作,点击“编辑”按钮,可对 高三化学必考知识点归纳 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:691f52ece86408a55f5bbdc113971908
思维导图大纲
高三化学必考知识点归纳思维导图模板大纲
有很多的学生在复习高三化学时,因为之前没有对知识进行系统的总结,导致复习时整体的效率低下。为了方便大家学习借鉴,下面树图网精心准备了高三化学必考知识点归纳内容,欢迎使用学习!
高三化学必考知识点归纳
1、SO2的性质:强的还原性、漂白性、弱的氧化性、酸性氧化物。
2、SO2通入氯化钡、氯化钙溶液都没有沉淀。但是通入硝酸钡溶液有沉淀。因为SO2在水溶液中生成亚硫酸,亚硫酸电离出氢离子与硝酸根构成硝酸,可以氧化SO2氧化成硫酸根离子,生成硫酸钡沉淀。
3、SO42-的检验:先加HCl无现象,后加BaCl2溶液有不溶于酸的白色沉淀
4、浓H2SO4沾到皮肤上,应立即用水冲洗,再用干燥布擦净,最后涂上NaHCO3溶液
5、除去SO2中的SO3可用饱和的亚硫酸氢钠或浓H2SO4
6、含有2molH2SO4的浓硫酸和1mol铜加热反应,得到的SO2不到1mol,原因是随反应的进行浓硫酸变成稀硫酸,稀硫酸和铜不反应。
7、SO2使石蕊变色而不褪色,SO2不能漂白石蕊。
8、常温下浓硫酸可以使铁铝钝化,钝化不是不反应,很快反应很快停止。钝化浓硫酸表现强氧化性。
9、S常温下是淡黄色固体,不溶于水,微溶于酒精易溶于CS2。S可以和热的氢氧化钠溶液反应。
10、浓硫酸有吸水性,但是不能干燥氨气、硫化氢、碘化氢、溴化氢。
11、向煤中加入适量的石灰石,可以大大减少燃烧产物中SO2的含量
12、酸雨:pH<5.6的降雨,酸雨的产生主要是工业上燃烧煤产生大量的SO2,我国的酸雨主要是硫酸酸雨,但是也有少量的硝酸酸雨。
13、臭氧层是地球生物的保护伞,但是臭氧不是越多越好,若超过10—5%对人体有害。破坏臭氧层的物质主要是氟利昂、氮氧化物。
14、H2O2的性质:(1)强氧化性:H2O2作氧化剂,还原产物一般为水。如H2O2可以氧化SO2、氯化亚铁(2)弱的还原性:如H2O2可以使高锰酸钾溶液退色。H2O2作还原剂,氧化产物为O2。(3)弱酸性(4)漂白性。
高三化学方程式
一. 物质与氧气的反应和几个分解反应:
1、 单质与氧气的反应:
①镁在空气中燃烧:2Mg + O2 点燃 2MgO
②铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O4
③铜在空气中受热:2Cu + O2 加热 2CuO
④铝在空气中燃烧:4Al + 3O2 点燃 2Al2O3
⑤氢气中空气中燃烧:2H2 + O2 点燃 2H2O
⑥红磷在空气中燃烧:4P + 5O2 点燃 2P2O5
⑦硫粉在空气中燃烧: S + O2 点燃 SO2
⑧碳在氧气中充分燃烧:C + O2 点燃 CO2
⑨碳在氧气中不充分燃烧:2C + O2 点燃 2CO
2、 化合物与氧气的反应:
①一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO2
②甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O
③酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O
3、 几个分解反应:
①水在直流电的作用下分解:2H2O 通电 2H2↑+ O2 ↑
②加热碱式碳酸铜:Cu22CO3 加热 2CuO + H2O + CO2↑
③加热氯酸钾:2KClO3 ==== 2KCl + 3O2 ↑
④加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 + O2↑
⑤碳酸不稳定而分解:H2CO3 === H2O + CO2↑
⑥高温煅烧石灰石:CaCO3 高温 CaO + CO2↑
二、几个氧化还原反应与单质、氧化物、酸、碱、盐的相互关系:
1、 几个氧化还原反应
① 氢气还原氧化铜:H2 + CuO 加热 Cu + H2O
②木炭还原氧化铜:C+ 2CuO 高温 2Cu + CO2↑
③焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe + 3CO2↑
④ 焦炭还原四氧化三铁:2C+ Fe3O4 高温 3Fe + 2CO2↑
⑤一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO2
⑥ 一氧化碳还原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO2
⑦一氧化碳还原四氧化三铁:4CO+ Fe3O4 高温 3Fe + 4CO2
2、 单质、氧化物、酸、碱、盐的相互关系
①金属单质 + 酸 -------- 盐 + 氢气
锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑
铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑
镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑
铝和稀硫酸2Al +3H2SO4 = Al23 +3H2↑
锌和稀盐酸Zn + 2HCl === ZnCl2 + H2↑
铁和稀盐酸Fe + 2HCl === FeCl2 + H2↑
镁和稀盐酸Mg+ 2HCl === MgCl2 + H2↑
铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑
②金属单质 + 盐 ------- 另一种金属 + 另一种盐
铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu
锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu
铜和硝酸汞溶液反应:Cu + Hg2 === Cu2 + Hg
③碱性氧化物 +酸 -------- 盐 + 水
氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O
氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe23 + 3H2O
氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O
氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O
氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O
氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O
④酸性氧化物 +碱 -------- 盐 + 水
苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O
苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O
苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O
消石灰放在空气中变质:Ca2 + CO2 ==== CaCO3 ↓+ H2O
消石灰吸收二氧化硫:Ca2 + SO2 ==== CaSO3 ↓+ H2O
⑤酸 + 碱 -------- 盐 + 水
盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O
盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O
盐酸和氢氧化铜反应:2HCl + Cu2 ==== CuCl2 + 2H2O
盐酸和氢氧化钙反应:2HCl + Ca2 ==== CaCl2 + 2H2O
盐酸和氢氧化铁反应:3HCl + Fe3 ==== FeCl3 + 3H2O
氢氧化铝药物治疗胃酸过多:3HCl + Al3 ==== AlCl3 + 3H2O
硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O
硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O
硫酸和氢氧化铜反应:H2SO4 + Cu2 ==== CuSO4 + 2H2O
硫酸和氢氧化铁反应:3H2SO4 + 2Fe3==== Fe23 + 6H2O
硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O
⑥酸 + 盐 -------- 另一种酸 + 另一种盐
大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑
碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑
盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓ + HNO3
硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑
硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4 ↓+ 2HCl
⑦碱 + 盐 -------- 另一种碱 + 另一种盐
氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu2↓ + Na2SO4
氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe3↓ + 3NaCl
氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg2↓ + 2NaCl
氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu2↓ + 2NaCl
氢氧化钙与碳酸钠:Ca2 + Na2CO3 === CaCO3↓+ 2NaOH
⑧盐 + 盐 ----- 两种新盐
氯化钠溶液和硝酸银溶液:NaCl + AgNO3 ==== AgCl↓ + NaNO3
硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl
三、有机化学方程式和其它反应:
1、 有机化学方程式
①甲烷燃烧
CH4+2O2→CO2+2H2O
甲烷隔绝空气高温分解
甲烷分解很复杂,以下是最终分解。CH4→C+2H2
甲烷和氯气发生取代反应
CH4+Cl2→CH3Cl+HCl
CH3Cl+Cl2→CH2Cl2+HCl
CH2Cl2+Cl2→CHCl3+HCl
CHCl3+Cl2→CCl4+HCl
实验室制甲烷
CH3COONa+NaOH→Na2CO3+CH4
②乙烯燃烧
CH2=CH2+3O2→2CO2+2H2O
乙烯和溴水
CH2=CH2+Br2→CH2Br-CH2Br
乙烯和水
CH2=CH2+H20→CH3CH2OH
乙烯和氯化氢
CH2=CH2+HCl→CH3-CH2Cl
乙烯和氢气
CH2=CH2+H2→CH3-CH3
乙烯聚合
nCH2=CH2→-[-CH2-CH2-]n-
氯乙烯聚合
nCH2=CHCl→-[-CH2-CHCl-]n-
实验室制乙烯
CH3CH2OH→CH2=CH2↑+H2O
③乙炔燃烧
C2H2+3O2→2CO2+H2O
乙炔和溴水
C2H2+2Br2→C2H2Br4
乙炔和氯化氢
两步反应:C2H2+HCl→C2H3Cl--------C2H3Cl+HCl→C2H4Cl2
乙炔和氢气
两步反应:C2H2+H2→C2H4→C2H2+2H2→C2H6
实验室制乙炔
CaC2+2H2O→Ca2+C2H2↑
以食盐、水、石灰石、焦炭为原料合成聚乙烯的'方程式。
CaCO3 === CaO + CO2 2CaO+5C===2CaC2+CO2
CaC2+2H2O→C2H2+Ca2
C+H2O===CO+H2-----高温
C2H2+H2→C2H4 ----乙炔加成生成乙烯
C2H4可聚合
④苯燃烧
2C6H6+15O2→12CO2+6H2O
苯和液溴的取代
C6H6+Br2→C6H5Br+HBr
苯和浓硫酸浓硝酸
C6H6+HNO3→C6H5NO2+H2O
苯和氢气
C6H6+3H2→C6H12
⑤乙醇完全燃烧的方程式
C2H5OH+3O2→2CO2+3H2O
乙醇的催化氧化的方程式
2CH3CH2OH+O2→2CH3CHO+2H2O
乙醇发生消去反应的方程式
CH3CH2OH→CH2=CH2+H2O
两分子乙醇发生分子间脱水
2CH3CH2OH→CH3CH2OCH2CH3+H2O
乙醇和乙酸发生酯化反应的方程式
CH3COOH+C2H5OH→CH3COOC2H5+H2O
⑥乙酸和镁
Mg+2CH3COOH→2Mg+H2
乙酸和氧化钙
2CH3COOH+CaO→2Ca+H2O
乙酸和氢氧化钠
CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH
乙酸和碳酸钠
Na2CO3+2CH3COOH→2CH3COONa+H2O+CO2↑
⑦甲醛和新制的氢氧化铜
HCHO+4Cu2→2Cu2O+CO2↑+5H2O
乙醛和新制的氢氧化铜
CH3CHO+2Cu→Cu2O+CH3COOH+2H2O
乙醛氧化为乙酸
2CH3CHO+O2→2CH3COOH
2、 其他反应
①二氧化碳溶解于水:CO2 + H2O === H2CO3
②生石灰溶于水:CaO + H2O === Ca2
③氧化钠溶于水:Na2O + H2O ==== 2NaOH
④三氧化硫溶于水:SO3 + H2O ==== H2SO4
⑤硫酸铜晶体受热分解:CuSO4·5H2O 加热 CuSO4 + 5H2O
⑥无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4·5H2O
高三化学易错易乱知识点
1.澄清石灰水中通入二氧化碳气体(复分解反应)
Ca(OH)2+CO2=CaCO3↓+H2O
现象:石灰水由澄清变浑浊。
相关知识点:这个反应可用来检验二氧化碳气体的存在。
不用它检验,CaCO3+CO2+H2O=Ca(HCO3)2沉淀消失,可用Ba(OH)2溶液。
2.镁带在空气中燃烧(化合反应)
2Mg+O2=2MgO
现象:镁在空气中剧烈燃烧,放热,发出耀眼的白光,生成白色粉末。
相关知识点:
(1)这个反应中,镁元素从游离态转变成化合态;
(2)物质的颜色由银白色转变成白色。
(3)镁可做照明弹;
(4)镁条的着火点高,火柴放热少,不能达到镁的着火点,不能用火柴点燃;
(5)镁很活泼,为了保护镁,在镁表面涂上一层黑色保护膜,点燃前要用砂纸打磨干净。
3.水通电分解(分解反应)
2H2O=2H2↑+O2↑
现象:通电后,电极上出现气泡,气体体积比约为1:2
相关知识点:
(1)正极产生氧气,负极产生氢气;
(2)氢气和氧气的体积比为2:1,质量比为1:8;
(3)电解水时,在水中预先加入少量氢氧化钠溶液或稀硫酸,增强水的导电性;
(4)电源为直流电。
4.生石灰和水反应(化合反应)
CaO+H2O=Ca(OH)2
现象:白色粉末溶解
相关知识点:
(1)最终所获得的溶液名称为氢氧化钙溶液,俗称澄清石灰水;
(2)在其中滴入无色酚酞,酚酞会变成红色;
(3)生石灰是氧化钙,熟石灰是氢氧化钙;
(4)发出大量的热。
5.实验室制取氧气
①加热氯酸钾和二氧化锰的混合物制氧气(分解反应)
2KClO3=MnO2(作催化剂)=2KCl+3O2↑
相关知识点:
(1)二氧化锰在其中作为催化剂,加快氯酸钾的分解速度或氧气的生成速度;
(2)二氧化锰的质量和化学性质在化学反应前后没有改变;
(3)反应完全后,试管中的残余固体是氯化钾和二氧化锰的混合物,进行分离的方法是:洗净、干燥、称量。
②加热高锰酸钾制氧气(分解反应)
2KMnO4=K2MnO4+MnO2+O2↑
相关知识点:在试管口要堵上棉花,避免高锰酸钾粉末滑落堵塞导管。
③过氧化氢和二氧化锰制氧气(分解反应)
2H2O2=MnO2(作催化剂)=2H2O+O2↑
共同知识点:
(1)向上排空气法收集时导管要伸到集气瓶下方,收集好后要正放在桌面上;
(2)实验结束要先撤导管,后撤酒精灯,避免水槽中水倒流炸裂试管;
(3)加热时试管要略向下倾斜,避免冷凝水回流炸裂试管;
(4)用排水集气法收集氧气要等到气泡连续均匀地冒出再收集;
(5)用带火星的小木条放在瓶口验满,伸入瓶中检验是否是氧气。
6.木炭在空气中燃烧(化合反应)
充分燃烧:C+O2=CO2
不充分燃烧:2C+O2=2CO
现象:在空气中发出红光;在氧气中发出白光,放热,生成一种使澄清石灰水变浑浊的无色气体。
相关知识点:反应后的产物可用澄清的石灰水来进行检验。
7.硫在空气(或氧气)中燃烧(化合反应)
S+O2=SO2
现象:在空气中是发出微弱的淡蓝色火焰,在氧气中是发出明亮的蓝紫色火焰,生成无色有刺激性气体。
相关知识点:
(1)应后的产物可用紫色的石蕊来检验(紫色变成红色);
(2)在集气瓶底部事先放少量水或碱溶液(NaOH)以吸收生成的二氧化硫,防止污染空气。
8.铁丝在氧气中燃烧(化合反应)
3Fe+2O2=Fe3O4
现象:铁丝在氧气中剧烈燃烧,火星四射,放热,生成黑色固体。
相关知识点:
(1)铁丝盘成螺旋状是为了增大与氧气的接触面积;
(2)在铁丝下方挂一根点燃的火柴是为了引燃铁丝;
(3)等火柴快燃尽在伸入集气瓶中,太早,火柴消耗氧气,铁丝不能完全燃烧;太晚,不能引燃;
(4)事先在集气瓶底部放少量细沙,避免灼热生成物溅落炸裂瓶底。
9.红磷在氧气中燃烧(化合反应)
4P+5O2=2P2O5
现象:产生大量白烟并放热。
相关知识点:可用红磷来测定空气中氧气含量。
10.氢气在空气中燃烧(化合反应)
2H2+O2=2H2O
现象:产生淡蓝色的火焰,放热,有水珠生成
相关知识点:
(1)氢气是一种常见的还原剂;
(2)点燃前,一定要检验它的纯度。
11.木炭还原氧化铜(置换反应)
C+2CuO=2Cu+CO2↑
现象:黑色粉末逐渐变成光亮的红色物质,放热。
相关知识点:
(1)把木炭粉和氧化铜铺放进试管,使受热面积大,反应快;
(2)导管通入澄清石灰水中,为了检验是否产生CO2;
(3)在酒精灯上加网罩使火焰集中并提高温度;
(4)先撤出导气管防止石灰水倒流炸裂试管;
(5)试管冷却后在把粉末倒出,防止灼热的铜的氧气发生反应,生成CuO;
(6)C是还原剂,CuO是氧化剂。
12.氢气还原氧化铜(置换反应)
H2+CuO=Cu+H2O
现象:黑色粉末逐渐变成光亮的红色物质,同时试管口有水滴生成。
相关知识点:
(1)实验开始时,应先通入一段时间氢气,目的是赶走试管内的空气;
(2)实验结束后,应先拿走酒精灯,后撤走氢气导管,目的是防止新生成的铜与空气中的氧气结合,又生成氧化铜。
13.实验室制取二氧化碳气体(复分解反应)
大理石(石灰石)和稀盐酸反应
CaCO3+2HCl=CaCl2+H2O+CO2↑
现象:白色固体溶解,同时有大量气泡产生。
相关知识点:
(1)碳酸钙是一种白色难溶的固体,利用它能溶解在盐酸中的特性,可以用盐酸来除去某物质中混有的碳酸钙;
(2)不能用浓盐酸是因为浓盐酸有挥发性,挥发出HCl气体混入CO2中。使CO2不纯;
(3)不能用稀硫酸是因为碳酸钙和硫酸反映,产生CaSO4微溶于水,覆盖在固体表面,使反应停止;
(4)不能用碳酸钙粉末是因为反应物接触面积大,反应速度太快。
14.工业制取二氧化碳气体(分解反应)
高温煅烧石灰石
CaCO3=CaO+CO2↑
相关知识点:CaO俗名为生石灰。
15.一氧化碳在空气中燃烧(化合反应)
2CO+O2=2CO2
现象:产生蓝色火焰。
相关知识点:
(1)一氧化碳是一种常见的还原剂;
(2)点燃前,一定要检验它的纯度。
16.一氧化碳还原氧化铜
CO+CuO=Cu+CO2
现象:黑色粉末逐渐变成光亮的红色粉末,生成气体使石灰水变浑浊。
相关知识点:一氧化碳是还原剂,氧化铜是氧化剂。
17.甲烷在空气中燃烧
CH4+2O2=CO2+2H2O
现象:火焰明亮呈浅蓝色
相关知识点:甲烷是天然气(或沼气)的主要成分,是一种很好的燃料。
18.工业制造盐酸(化合反应)
H2+Cl2=2HCl
相关知识点:该反应说明了在特殊条件下燃烧不一定需要氧气。
19.实验室制取氢气(置换反应)
Zn+H2SO4=ZnSO4+H2↑
相关知识点:
(1)氢气是一种常见的还原剂;
(2)点燃前,一定要检验它的纯度。
20.木炭和二氧化碳生成一氧化碳(化合反应)
C+CO2=2CO
相关知识点:
(1)一氧化碳是一种常见的还原剂;
(2)点燃前,一定要检验它的纯度。
相关思维导图模板


树图思维导图提供 卫生化学--元素和无机物分析 在线思维导图免费制作,点击“编辑”按钮,可对 卫生化学--元素和无机物分析 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:4c942d0350c858e06a1f7ed29a86d096

树图思维导图提供 人教版必修一:分子与细胞 在线思维导图免费制作,点击“编辑”按钮,可对 人教版必修一:分子与细胞 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:38b99f99a660f9eb846aafd51549cc03










 上海工商
上海工商