高考化学必背知识点归纳总结思维导图

在高考复习期间,化学科目的备考是相对比较轻松的,但是我们也要注意根据考纲来复习知识点,重视常考的知识的复习。
树图思维导图提供 高考化学必背知识点归纳总结 在线思维导图免费制作,点击“编辑”按钮,可对 高考化学必背知识点归纳总结 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:234ee86e80593bfc333c465435e25aae
思维导图大纲
高考化学必背知识点归纳总结思维导图模板大纲
在高考复习期间,化学科目的备考是相对比较轻松的,但是我们也要注意根据考纲来复习知识点,重视常考的知识的复习。下面树图网给大家整理了关于高考化学必背知识点归纳总结的内容,欢迎阅读,内容仅供参考!
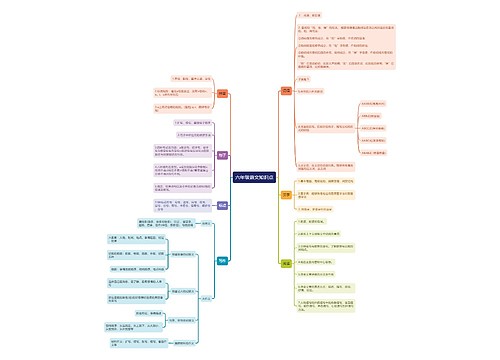
高考化学必背知识点归纳总结
化学重点现象
1、铝片与盐酸反应是放热的,Ba(OH)2与NH4Cl反应是吸热的;
2、Na与H2O(放有酚酞)反应,熔化、浮于水面、转动、有气体放出;(熔、浮、游、嘶、红)
3、焰色反应:Na黄色、K紫色(透过蓝色的钴玻璃)、Cu绿色、Ca砖红、Na+(黄色)、K+(紫色)。
4、Cu丝在Cl2中燃烧产生棕色的烟;
5、H2在Cl2中燃烧是苍白色的火焰;
6、Na在Cl2中燃烧产生大量的白烟;
7、P在Cl2中燃烧产生大量的白色烟雾;
8、SO2通入品红溶液先褪色,加热后恢复原色;
9、NH3与HCl相遇产生大量的白烟;
10、铝箔在氧气中激烈燃烧产生刺眼的白光;
11、镁条在空气中燃烧产生刺眼白光,在CO2中燃烧生成白色粉(MgO),产生黑烟;
12、铁丝在Cl2中燃烧,产生棕色的烟;
13、HF腐蚀玻璃4HF+SiO2=SiF4+2H2O
14、Fe(OH)2在空气中被氧化:由白色变为灰绿最后变为红褐色;
15、在常温下:Fe、Al在浓H2SO4和浓HNO3中钝化;
16、向盛有苯酚溶液的试管中滴入FeCl3溶液,溶液呈紫色;苯酚遇空气呈粉红色。
17、蛋白质遇浓HNO3变黄,被灼烧时有烧焦羽毛气味;
18、在空气中燃烧:S——微弱的淡蓝色火焰H2——淡蓝色火焰H2S——淡蓝色火焰CO——蓝色火焰CH4——明亮并呈蓝色的火焰S在O2中燃——明亮的蓝紫色火焰。
19、特征反应现象:
20、浅黄色固体:S或Na2O2或AgBr
21、使品红溶液褪色的气体:SO2(加热后又恢复红色)、Cl2(加热后不恢复红色)
22.有色溶液:Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、MnO4-(紫色)
有色固体:红色(Cu、Cu2O、Fe2O3)、红褐色[Fe(OH)3]黑色(CuO、FeO、FeS、CuS、Ag2S、PbS)
蓝色[Cu(OH)2]黄色(AgI、Ag3PO4)白色[Fe(0H)2、CaCO3、BaSO4、AgCl、BaSO3]
有色气体:Cl2(黄绿色)、NO2(红棕色)
高考化学常见方程式
1 偏铝酸钠溶液与少量的盐酸反应: NaAlO2+HCl(少量)+H2O=NaCl + Al(OH)3
2 偏铝酸钠溶液与足量的盐酸反应: NaAlO2+4HCl(过量)=NaCl+AlCl3+2H2O
3 硫酸铝与氨水:Al2(SO4)3+6NH3.H2O=2Al(OH)3沉淀+3(NH4)2SO4
4 氯化铝与氢氧化钠:AlCl3+3NaOH=Al(OH)3沉淀+3NaCl
5 氯化铝与氨水:AlCl3+3NH3·H2O==Al(OH)3↓+3NH4Cl(反应到此为止不再继续)
6 氯化铝与氢氧化钠:AlCl3+4NaOH=NaAlO2+2H2O
7 氢氧化钡溶液与稀H2SO4反应:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
Ba(OH)2 + H2SO4 == BaSO4 + 2H2O
8 硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
H2SO4+Ba(OH)2=BaSO4+2H2O
9 硫酸氢钠溶液中加入氢氧化钡溶液至硫酸根沉淀完全:
H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
NaHSO4+ Ba(OH)2=BaSO4↓+NaOH+H2O
10 碳酸氢钠溶液和氢氧化钠溶液混合HCO3-+OHˉ=CO32-+H2O
NaHCO3+ NaOH=Na2CO3+H2O
11 氢氧化钠溶液中加入过量碳酸氢钙溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
NaOH+CaHCO3=CaCO3↓+ Na2CO3+H2O
12 氢氧化钠溶液中加入少量碳酸氢钙溶液:Ca2++2HCO3-+2OH-=CaCO3↓+H2O+ CO32-
NaOH+CaHCO3=CaCO3↓+Na2CO3+H2O
13 向AlCl3溶液中加入少量的NaOH溶液:Al3+ + 3OH- =Al(OH)3↓
AlCl3+3NaOH=Al(OH)3+3NaCl
14 向AlCl3溶液中加入过量的NaOH溶液:Al3+ +4OH-=AlO2-+2H2O
AlCl3+3NaOH=Al(OH)3+3NaCl
NaAlO4+3NaCl
15 氯化铁溶液中加过量氨水:Fe 3++3NH3•H2O= Fe(OH)3↓+3NH4+
FeCl3+3NH3•H2O= Fe (OH)3↓+3NH4Cl
16 氯化铝溶液中加入过量的氨水A13++3NH3•H2O=Al(OH)3↓+3NH4+
A1Cl3+3NH3•H2O= Al(OH)3↓+3NH4Cl
17 氯化铝溶液中加入少量的氨水(同上) A13++3NH3•H2O=Al(OH)3↓+3NH4+
A1Cl3+3NH3•H2O= Al(OH)3↓+3NH4Cl
18 澄清石灰水与少量小苏打溶液混合:Ca2+十OH-+HCO3-=CaCO3↓+H2O
Ca(OH)2+NaHCO3-= CaCO3↓+NaOH+H2O
19 澄清石灰水与过量小苏打溶液混合:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+ CO32-
Ca(OH)2+NaHCO3= CaCO3↓+NaOH+H2O
NaOH+NaHCO3= Na2CO3↓+ H2O
Ca(OH)2+2NaHCO3= CaCO3↓+2H2O+ NA2CO3
20 铝片溶于苛性钠溶液:2Al+2OH-+2H2O =2AlO2-+3H2↑
2Al+2NaOH=2NaAlO2+3H2↑
高考化学常错知识点
常错点1 错误认为任何情况下,c(H+)和c(OH-)都可以通过KW=1×10-14进行换算。
解析 KW与温度有关,25 ℃时KW=1×10-14,但温度变化时KW变化,c(H+)和c(OH-)不能再通过KW=1×10-14进行换算。
常错点2 错误认为溶液的酸碱性不同时,水电离出的c(OH-)和c(H+)也不相等。
解析 由水的电离方程式H2O==OH-+H+可知,任何水溶液中,水电离出的c(OH-)和c(H+)总是相等的,与溶液的酸碱性无关。
常错点3 酸、碱、盐溶液中,c(OH-)或c(H+)的来源混淆。
解析 (1)酸溶液中,c(OH-)水电离=c(OH-)溶液;
碱溶液中,c(H+)水电离=c(H+)溶液。
(2)盐溶液中,若为强酸弱碱盐,c(H+)水电离=c(H+)溶液;
若为强碱弱酸盐,c(OH-)水电离=c(OH-)溶液。
常错点4 错误认为只要Ksp越大,其溶解度就会越大。
解析 Ksp和溶解度都能用来描述难溶电解质的溶解能力。但是只有同种类型的难溶电解质才能直接用Ksp的大小来判断其溶解度的大小;若是不同的类型,需要计算其具体的溶解度才能比较。
常错点5 错误地认为原电池的两个电极中,相对较活泼的金属一定作负极。
解析 判断原电池的电极要根据电极材料和电解质溶液的具体反应分析,发生氧化反应的是负极,发生还原反应的是正极。
如在Mg—Al—稀H2SO4组成的原电池中,Mg为负极,而在Mg—Al—NaOH溶液组成的原电池中,Al作负极,因为Al可与NaOH溶液反应,Mg不与NaOH溶液反应。
常错点6 在电解食盐水的装置中,错误地认为阳极区显碱性。
解析 电解食盐水时,阴极H+放电生成H2,使水的电离平衡正向移动,OH-浓度增大,阴极区显碱性。
常错点7 错误地认为钠在过量氧气中燃烧生成Na2O2,在适量或少量氧气中燃烧生成Na2O。
解析 钠与氧气的反应产物与反应条件有关,将金属钠暴露在空气中生成Na2O,在空气或氧气中燃烧生成Na2O2。
常错点8 错误地认为钝化就是不发生化学变化,铝、铁与浓硫酸、浓硝酸不发生反应。
解析 钝化是在冷的浓硫酸、浓硝酸中铝、铁等金属的表面形成一层致密的氧化膜而阻止了反应的进一步进行,如果加热氧化膜会被破坏,反应就会剧烈进行。所以钝化是因发生化学变化所致;铝、铁等金属只在冷的浓硫酸、浓硝酸中发生钝化,加热时会剧烈反应。
常错点9 错误地认为,金属的还原性与金属元素在化合物中的化合价有关。
解析 在化学反应中,金属的还原性强弱与金属失去电子的难易程度有关,与失去电子的数目无关,即与化合价无关。
常错点10 错误地认为可用酸性高锰酸钾溶液去除甲烷中的乙烯。
解析 乙烯被酸性高锰酸钾氧化后产生二氧化碳,故不能达到除杂目的,必须再用碱石灰处理。
常错点11 错误地认为苯和溴水不反应,故两者混合后无明显现象。
解析 虽然两者不反应,但苯能萃取水中的溴,故看到水层颜色变浅或褪去,而苯层变为橙红色。
常错点12 错误地认为用酸性高锰酸钾溶液可以除去苯中的甲苯。
解析 甲苯被氧化成苯甲酸,而苯甲酸易溶于苯,仍难分离。应再用氢氧化钠溶液使苯甲酸转化为易溶于水的苯甲酸钠,然后分液。
常错点13 错误地认为苯酚酸性比碳酸弱,故苯酚不能与碳酸钠溶液反应。
解析 苯酚的电离能力虽比碳酸弱,但却比碳酸氢根离子强,所以由复分解规律可知:苯酚和碳酸钠溶液能反应生成苯酚钠和碳酸氢钠。
常错点14 错误地认为欲除去苯中的苯酚可在其中加入足量浓溴水,再把生成的沉淀过滤除去。
解析 苯酚与溴水反应后,多余的溴易被萃取到苯中,而且生成的三溴苯酚虽不溶于水,却易溶于苯,所以不能达到目的。
常错点15 错误地认为能发生银镜反应的有机物一定是醛。
解析 葡萄糖、甲酸、甲酸某酯可发生银镜反应,但它们不是醛。
常错点16 错误地认为油脂是高分子化合物。
解析 高分子化合物有两个特点:一是相对分子质量很大,一般几万到几百万;二是高分子化合物的各个分子的n值不同,无固定的相对分子质量。而油脂的相对分子质量是固定的,一般在几百范围内,油脂不属于高分子化合物。
常错点17 使用试管、烧瓶加热液体时,忽视对液体量的要求,所加液体过多。
解析 用试管加热液体时,液体不能超过试管容积的3(1)。用烧瓶加热液体时,液体不能超过烧瓶容积的2(1)。
常错点18 使用托盘天平称量固体药品时,记错药品和砝码位置,称量NaOH固体时,误将药品放在纸上。
解析 用托盘天平称量药品时,应是左物右码。称量NaOH固体时,应将NaOH放在小烧杯内或放在称量瓶内。
常错点19 混淆量筒和滴定管的刻度设置,仰视或俯视读数时,将误差分析错误。
解析 量筒无"0"刻度,且刻度值从下往上增大,滴定管的"0"刻度在上端,从上往下增大。观察刻度时相同的失误,误差相反。
常错点20 混淆试纸的使用要求,测pH时误将pH试纸用蒸馏水润湿。
解析 使用石蕊试纸、淀粉KI试纸时要先用蒸馏水润湿,使用pH试纸时,不能将试纸润湿,否则等于将溶液稀释。
相关思维导图模板

树图思维导图提供 1113爆卡会总结会会议纪要 在线思维导图免费制作,点击“编辑”按钮,可对 1113爆卡会总结会会议纪要 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:aaf6c152a765d5821e8e1787f2b3226e

树图思维导图提供 抓住重点 在线思维导图免费制作,点击“编辑”按钮,可对 抓住重点 进行在线思维导图编辑,本思维导图属于思维导图模板主题,文件编号是:4c49e4799ddf94a339c56e46eb96a826







 上海工商
上海工商